
分析 已知①N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ/mol,②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534KJ/mol,
依据盖斯定律②×2-①得到肼与NO2完全反应的热化学方程式.
解答 解:已知①N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ/mol,
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534KJ/mol,
依据盖斯定律②×2-①可得肼与NO2完全反应的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
点评 本题考查了热化学方程式的书写及盖斯定律的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握热化学方程式的书写原则.


科目:高中化学 来源: 题型:选择题
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 一个化学反应的△H与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关 | |
| C. | 中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差 | |
| D. | 在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
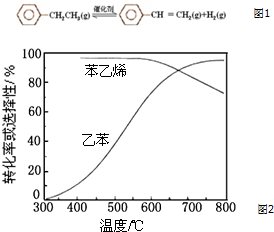 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | X | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ①③⑦ | C. | ②④⑥ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔比1:1 | B. | 摩尔比1:2 | C. | 质量比1:1 | D. | 质量比7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用98%的浓硫酸替代稀硫酸 | B. | 降低温度 | ||
| C. | 用铝粉代替铝片 | D. | 加入Na2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com