
| A�� | ���������ʹƷ����ɫ | |
| B�� | ����������뱽�ӻ��ʹ�� | |
| C�� | �������������ֻ���м��Լ� | |
| D�� | �����������ǻ����ᣨHOCH2COOH����Ϊͬ���칹�� |
���� A���������ᣨCH3COOOH����һ�ָ�Ч�����������к�ǿ�������Ժ�ʴ�ԣ���ʹƷ����Һ��ɫ��
B���������ʲ��ȶ����ױ�������
C��������������д���C-H��C-O��O-H���Լ���Ҳ����C-C��O-O����
D������ʽ��ͬ�ṹ��ͬ���л��ﻥ��ͬ���칹�壮
��� �⣺A���������ᣨCH3COOOH����һ�ָ�Ч�����������к�ǿ�������Ժ�ʴ�ԣ��ܽ�Ʒ����Һ������ʹƷ����Һ��ɫ����A����
B���������ʲ��ȶ����ױ������������������ǿ�����ԣ��������������ӣ���B����
C��������������д���C-H��C-O��O-H���Լ���Ҳ����C-C��O-O�Ǽ��Լ�����C����
D�������������ǻ����ᣨHOCH2COOH������ʽ��ͬ���ṹ��ͬ�����Ի�Ϊͬ���칹�壬��D��ȷ��
��ѡD��
���� ���⿼���л���ṹ�����ʼ�����������ؿ���ѧ����ȡ��Ϣ������������Ϣ�������������ע����������д��ڵĻ�ѧ������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��������ڴ��ڼ��ԡ��Ǽ��Լ���
��������ڴ��ڼ��ԡ��Ǽ��Լ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�11.2L�ƾ�����������Ϊ0.5NA | |
| B�� | 40gNaOH������������ΪNA | |
| C�� | 1 L NaCl��Һ�У�������������Ϊ2 NA | |
| D�� | ��״���£�22.4L��������NA����ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �Ȼ�����Һ | C�� | �Ȼ�ͭ��Һ | D�� | �Ȼ�þ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
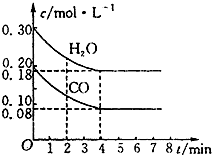 ��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0��CO��H2O��Ũ�ȱ仯��ͼ��ʾ��850��ʱ����Ũ�ȵı仯������0��4min��ƽ����Ӧ����v��CO��=0.03mol•L-1•min-1��
��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0��CO��H2O��Ũ�ȱ仯��ͼ��ʾ��850��ʱ����Ũ�ȵı仯������0��4min��ƽ����Ӧ����v��CO��=0.03mol•L-1•min-1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2NaOH+H2SO4=Na2SO4+2H2OB | B�� | Cl2+H2O=HCl+HClO | ||
| C�� | CaO+H2O=C a��OH��2 | D�� | CaCO3$\frac{\underline{\;����\;}}{\;}$CaO+CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
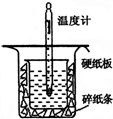 �к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�飮ȡ0.55mol/L��NaOH��Һ50mL��0.50mol/L������50mL������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺
�к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�飮ȡ0.55mol/L��NaOH��Һ50mL��0.50mol/L������50mL������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com