
分析 (1)氯化镁属于离子晶体,金刚石属于原子晶体,氢氧化钠属于离子晶体,干冰属于分子晶体,碘晶体属于分子晶体,分子晶体熔化时不需要破坏化学键,原子晶体、离子晶体熔化时需要破坏化学键;
一般物质熔点:原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量越大,分子间作用力越强,物质的熔点越高;
(2)氯化镁、氢氧化钠属于离子化合物,氯化镁只含有离子键,分子晶体以分子间作用力结合.
解答 解:(1)氯化镁属于离子晶体,金刚石属于原子晶体,氢氧化钠属于离子晶体,干冰属于分子晶体,碘晶体属于分子晶体,熔化时不需要破坏化学键的是干冰、碘晶体,熔化时需要破坏共价键的是金刚石,氯化镁、氢氧化钠熔化平衡离子键,
一般物质熔点:原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量越大,分子间作用力越强,物质的熔点越高,故熔点最高的是金刚石,熔点最低的是干冰,
故答案为:干冰、碘晶体;金刚石;金刚石;干冰;
(2)氯化镁、氢氧化钠属于离子化合物,氢氧化钠含有离子键、共价键,而氯化镁只含有离子键,干冰、碘晶体以分子间作用力结合,
故答案为:氯化镁;干冰、碘晶体.
点评 本题考查晶体类型、熔沸点高低比较等,注意掌握晶体构成微粒与微粒间作用,理解掌握熔沸点比较规律.


科目:高中化学 来源: 题型:解答题
| 实 验 目 的 | 化学试剂及方法 | 供选择的化学试剂及方法 A.加入硝酸酸化的硝酸银溶液 B.加入食醋,加热 C.灼烧、闻气味 D.加入新制氢氧化铜悬浊液,加热 E.将样品滴在淀粉碘化钾试纸上 |
| 除去热水瓶中的水垢 | ||
| 鉴别蔗糖和葡萄糖 | ||
| 验证味精中是否含有食盐 | ||
| 区别毛织物和棉织物 | ||
| 检验自来水是否含Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫 | B. | 盖斯 | C. | 勒夏特列 | D. | 范德华 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 漂白粉的成分为次氯酸钙 | |
| D. | SO2可用于漂白食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
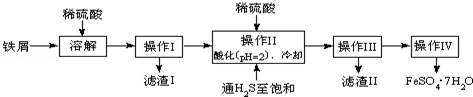
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com