
某有机物n g,跟足量金属钠反应生成V L H2,另取n g该有机物与足量碳酸氢钠作用生成V L CO2(相同状况下),该有机物分子中含有的官能团为( )
A.含一个羧基和一个羟基
B.含两个羧基
C.只含一个羧基
D.含两个羟基
科目:高中化学 来源: 题型:
已知还原性:HSO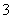 >I-,氧化性:IO
>I-,氧化性:IO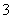 >I2。
>I2。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并标出电子转移的方向和数目。
□NaIO3+□NaHSO3―→□I2+□Na2SO4+□H2SO4+□H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全,推测反应后溶液中的还原产物为________________(填化学式)。
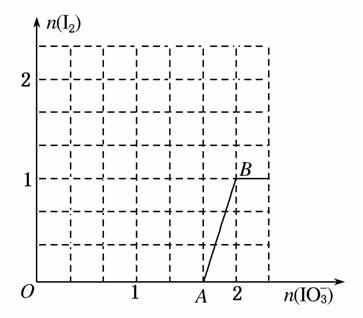
(3)在含5 mol NaHSO3的溶液中逐滴加入NaIO3溶液,加入NaIO3的物质的量和析出I2的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式____________;当溶液中I-与I2的物质的量之比为53时,加入的NaIO3为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
[已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7]

(金属离子含量与混合液pH、CuCl产率与混合液pH的关系图)
请回答下列问题:
(1)酸浸时发生反应的离子方程式是______________________;析出CuCl晶体时的最佳pH在____左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________________________________________________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70 ℃干燥2小时、冷却,密封包装。70 ℃真空干燥、密封包装的目的是_____________________________________________________________。
(4)产品滤出时所得滤液的主要成分是________________,若想从滤液中获取FeSO4·7H2O晶体,我们还需要知道的是_____________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式________________________________________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇与乙酸反应生成乙酸乙酯,说明乙醇具有碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
观察下图中物质分子的比例模型及其变化,请回答下列问题:
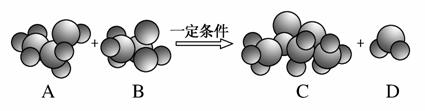
(1)A是乙醇,则B、C的结构简式分别为__________________、__________________。
(2)上图所示化学方程式中的“一定条件”是________________________________________________________________________。
(3)反应物中只有乙醇分子中的氧原子是18O,生成物中含这种氧原子的是(写物质名称)________。
(4)在B的分子中,最外层电子数为8的原子有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
例海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
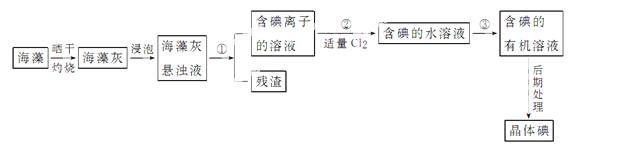
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;写出实验②中有关反应的离子方程式_______。
(2)提取碘的过程中,可供选择的有关试剂是 。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(3)从海藻灰中碘离子转化到碘的有机溶液,实验室准备了烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。如右图所示,还缺少的玻璃仪器是________。
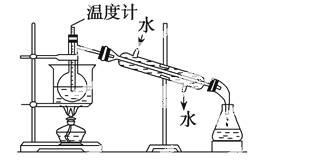
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处:①_______, ② ,③ 。
(5)进行上述蒸馏操作时,使用水浴的原因是 ;最后,晶体碘在 里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO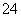 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO ,选出a所代表的试剂,按滴加顺序依次为____________(只填化学式)。
,选出a所代表的试剂,按滴加顺序依次为____________(只填化学式)。
(2)用于沉淀的试剂需过量,判断除去SO 的试剂过量的方法是________________。
的试剂过量的方法是________________。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
________________________________________________________________________
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨在材料领域有重要应用。某初级石墨中含 SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
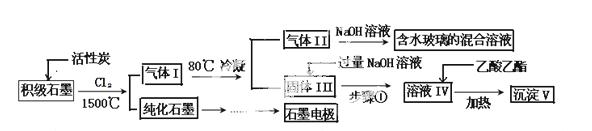
(注:SiCl4的沸点是 57.6ºC,金属氯化物的沸点均高于150ºC)
57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化 学方程式为 。
学方程式为 。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有 。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100kg初级石墨最多可获得V的质量为 kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成图19防腐示意图,并作相应标注。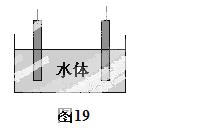
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com