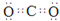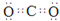(2011?唐山模拟)[化学--选修3:物质结构与性质]W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为ms
nmp
n.请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是
SP2
SP2
,该分子中含有
1
1
个π键.
(2)Z原子的核外电子排布式为
1s22s22p63s23p63d104S1
1s22s22p63s23p63d104S1
;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH
3之间的化学键为
配位键
配位键
.
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
原子晶体
原子晶体
晶体;Q、R、X三种元素的第一电
离能数值由小到大的顺序为
C<O<N
C<O<N
(用元素符号回答).
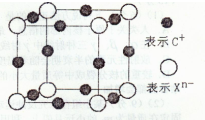
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示.该晶体中阳离子和阴离子个数比为
3:1
3:1
,晶体中每个Xn-被
6
6
个等距离的C+离子包围.