
| A. | 1L0.1mol/L醋酸 | B. | 0.1L 0.1mol/L H2SO4溶液 | ||
| C. | 0.5L 0.1mol/L盐酸 | D. | 2L 0.1mol/L H2SO3溶液 |
分析 溶液的导电性取决于溶液离子浓度大小,离子浓度越大,则导电性越强,分别计算溶液中离子浓度总和分析判断,强电解质溶液中离子浓度=溶质浓度×离子数,弱电解质溶液中存在电离平衡,电离程度较小,多元弱酸分步电离,以此解答.
解答 解:A、醋酸为弱电解质,溶液中存在电离平衡,CH3COOH?CH3COO-+H+,不能完全电离成离子,溶液中阴阳离子总浓度小于0.2moL/L;
B、0.1mol/LH2SO4溶液中硫酸为强电解质完全电离,阴阳离子总浓度等于0.3mol/L;
C、0.1mol/L 盐酸中HCl为强电解质完全电离,阴阳离子总浓度等于0.2mol/L;
D、0.1mol/LH2SO3溶液中亚硫酸为弱电解质,H2SO3不能完全电离,溶液中分步电离,H2SO3?H++HSO3-,HSO3-?H++SO32-,则阴阳离子总浓度应略大于0.2mol/L;
则离子浓度最大的为B,导电性应最强,
故选B.
点评 本题考查电解质溶液的导电性强弱的比较,难度不大,注意把握电解质的强弱以及溶液总离子浓度的大小比较.


科目:高中化学 来源: 题型:选择题
| A. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| B. | 往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解 | |
| C. | 纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体 | |
| D. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘粒子带电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 学生甲 | 学生乙 |
| A | 向NaHCO3溶液中逐滴加入盐酸 | 向盐酸中逐滴加入NaHCO3溶液 |
| B | 向AlCl3溶液中滴加NaOH溶液 | 向NaOH溶液中滴加入AlCl3溶液 |
| C | 向FeCl2溶液中滴加KSCN溶液,再通入Cl2 | 向FeCl2溶液中通入Cl2,再滴加KSCN溶液 |
| D | 向Al2(SO4)3溶液中滴加氨水 | 向Al2(SO4)3溶液中滴加NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,17gH2O2中含极性键的数目为NA | |
| B. | 1L 1mo/L的Fe2(SO4)3溶液中含有的硫酸根离子数为3NA | |
| C. | 标准状况下,11.2LN2和H2的混合气体中所含原子数为NA | |
| D. | 5.6gFe溶于1L 0.3moL/L硝酸中,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
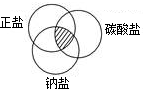 对于数以万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可代替的.现有碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液等六种物质.通过常见分类法中的交叉分类法,可推出符合右上图阴影的物质的化学式是Na2CO3.
对于数以万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可代替的.现有碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液等六种物质.通过常见分类法中的交叉分类法,可推出符合右上图阴影的物质的化学式是Na2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液 | |
| B. | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去,证明生成的气体全部是乙烯 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口倒出,重复2~3次 | |
| D. | 取5mL0.1mol•L-1KI溶液,滴加0.1mol•L-1FeCl3溶液5~6滴,继续加入2mLCCl4,充分振荡后静置,取上层溶液加KSCN溶液,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com