
分析 (1)同周期从左向右金属性减弱,同主族从上到下金属性增强;
(2)同周期从左向右非金属性增强,同主族从上到下非金属性减弱;
(3)金属性越强,对应碱的碱性越强;非金属性越强,对应最高价含氧酸的酸性越强;
(4)金属性越强,与水反应越剧烈;
(5)主族元素的最外层电子数=族序数=最高正价数.
解答 解:(1)同周期从左向右金属性减弱,同主族从上到下金属性增强,则金属性:Mg<Cs、Ge<Sn,
故答案为:<;<;
(2)同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则非金属性:N>As、F>S,
故答案为:>;>;
(3)金属性越强,对应碱的碱性越强;非金属性越强,对应最高价含氧酸的酸性越强,则酸性:Al(OH)3<H2CO3、HClO4>H3PO4,
故答案为:<;>;
(4)金属性越强,与水反应越剧烈,则与水反应的剧烈程度Ca>Mg、Be<K,故答案为:>;<;
(5)主族元素的最外层电子数=族序数=最高正价数,则主族序数=原子最外层电子数=元素最高正化合价数,
故答案为:═;=.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
 有一透明强酸性溶液,可能含K+、NH4+、Al3+、Cu2+、Fe2+、SO42-、SiO32-、CO32-、NO3-等离子中的若干种,现做如下实验:
有一透明强酸性溶液,可能含K+、NH4+、Al3+、Cu2+、Fe2+、SO42-、SiO32-、CO32-、NO3-等离子中的若干种,现做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | MgSO4═Mg+2+SO4-2 | B. | Ba(OH)2═Ba2++(OH-)2 | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | Ca(NO3)2═Ca2++2NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④① | B. | ④②③① | C. | ④①②③ | D. | ③④①② |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
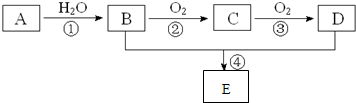
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+,CO32-,Cl-,Na+ | B. | Al3+,NH4+,OH-,NO3- | ||
| C. | Ag+,Br-,SO42-,K+ | D. | NO3-,Na+,H+,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
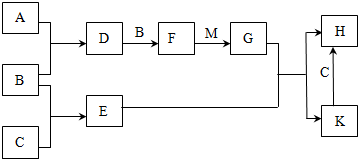
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com