
| A. | 液氨常被用作制冷剂 | |
| B. | 可利用2Fe3++Cu═Cu2++2Fe2+腐蚀印刷电路板 | |
| C. | 为便于储存和使用,可用液氯代替氯水漂白干燥棉布上的有色物质为便于储存和使用,可用液氯代替氯水漂白干燥棉布上的有色物质 | |
| D. | 已知3Cl2+2NH3═N2+6HCl,工业上可用浓氨水检查氯气管道是否漏气 |
分析 A.根据NH3易液化,可作制冷剂;
B.Fe3+具有强氧化性,可氧化铜;
C.液氯不具有漂白性;
D.若管道漏气,反应生成氯化铵,遇氨就会产生白烟.
解答 解:A.因NH3易液化,液氨常用作制冷剂,故A正确;
B.Fe3+具有强氧化性,可氧化铜,发生2Fe3++Cu═Cu2++2Fe2+腐蚀印刷电路板,故B正确;
C.起漂白作用的为HClO,液氯不具有漂白性,故C错误;
D.若管道漏气,氨与氯化氢反应生成氯化铵,生成白烟,可用浓氨水检查氯气管道是否漏气,故D正确.
故选C.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的结论,题目有利于培养学生良好的科学素养,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2与CO2反应,转移的电子数为0.2NA | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2 NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 1mol氢氧根离子中含有的电子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH和H2 | B. | Cu(OH)2、NaCl和H2 | C. | Cu和NaCl | D. | NaCl、Cu(OH)2和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③④ | C. | ②③⑤ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4 C2H4 | B. | CH4 C2H6 | C. | C2H4 C3H4 | D. | C2H2 C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
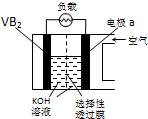 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )| A. | 电极a为电池正极 | |
| B. | 图中选择性透过膜只能让阳离子选择性透过 | |
| C. | 电子由VB2极经KOH溶液流向a电极 | |
| D. | VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8gO2含有4nA个电子 | |
| B. | 标准状况下22.4 L的NH3溶于水,所得溶液中有nA个NH4+ | |
| C. | 200mL的5mol•L-1盐酸中含有nA个HCl分子 | |
| D. | 1mol Na被完全氧化生成Na2O2,失去2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com