
| A. | HF、HCl、HBr 的沸点依次升高 | |
| B. | O、S、Na、K 的原子半径依次增大 | |
| C. | H2S、PH3、HCl、HF 的热稳定性依次增强 | |
| D. | Mg(OH)2、Al(OH)3、KOH、Ca(OH)2 的碱性依次增强 |
分析 A.根据氢键和分子间作用力分析三种气体的沸点高低;
B.同一周期,元素的原子半径随着原子序数的增大而减小;同一主族,元素的原子半径随着原子序数的增大而增大;
C.元素的非金属性越强,其氢化物的稳定性越强,同一周期,非金属性随着原子序数的增加而增大,同一主族的元素,非金属性随着原子序数的增加而减小;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,同周期元素从左到右金属性逐渐减弱,同一主族金属性随着原子序数的增加而增大.
解答 解:A.由于HF分子之间除分子间作用力之外还能形成氢键,因此HF的沸点要比HCl的高,而对于HCl、HBr来说,由于分子间作用力随相对分子质量的增大而增加,HCl、HBr、HF 三者的沸点依次身高,故A错误;
B.O、S属于同一主族,O的原子序数小于S的,所以O的原子半径小于S的原子半径,Na、K 属于同一主族,Na的原子序数小于K,所以Na的原子半径小于K的原子半径,S、Na属于同一周期,且Na的原子序数小于S的原子序数,所以Na的原子半径大于S的原子半径,O、S、Na、K 的原子半径依次增大,故B正确;
C.P、S、Cl为同一周期,F、Cl为同一主族,元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>S>P,所以氢化物的稳定性HF>HCl>H2S>PH3,故C错误;
D.Mg、Al为同一周期,K、Ca为同一周期,Mg、Ca为同一主族,金属性:K>Ca>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则Al(OH)3、Mg(OH)2、Ca(OH)2、KOH的碱性依次增强,故D错误;
故选B.
点评 本题考查元素周期律,侧重考查元素金属性、非金属性强弱判断,注意元素的非金属性、金属性与元素对应单质、化合物的关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑧ | B. | ②④ | C. | ①②⑤ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
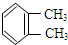 与
与 是同一物质;
是同一物质;| A. | ①②③④ | B. | ①③④ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如图所示.该结构中氯原子有两种不同位置.
白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如图所示.该结构中氯原子有两种不同位置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH试纸放入溶液,观察其颜色变化,跟标准比色卡比较 | |
| B. | 用干燥洁净的玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 | |
| C. | 用蒸馏水湿润pH试纸,用玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 | |
| D. | 在试管内放入少量溶液煮沸,把pH试纸放在试管口上观察,跟标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | Na和I2 | C. | 蔗糖和干冰 | D. | 金刚石和石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com