
二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。它的熔点-80℃,沸点138℃。常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊。
(1)写出S2Cl2的电子式_____________________,该分子中Cl—S的键长_______S—S的键长(填“>”,“<”或“=”)。
(2)S2Cl2遇水反应产生气体,该气体分子的空间构型为 ,中心原子的杂化轨道类型为____ 。
(3)HF、H2S、HCl的稳定性由大到小的顺序为 ,沸点由高到低的顺序
为 。
(4)写出二氯化硫与水反应的化学方程式 。
(1)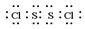 ; < ;(2)V形;sp2;
; < ;(2)V形;sp2;
(3)HF>HCl>H2S ; HF>HCl>H2S ; (4)2S2Cl2+2H2O=SO2 ↑+3S↓+4HCl
解析试题分析:(1)S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,电子式为 ;同周期自左向右原子半径逐渐减小,所以S原子半径大于氯原子半径,故Cl-S的键长<S-S的键长。
;同周期自左向右原子半径逐渐减小,所以S原子半径大于氯原子半径,故Cl-S的键长<S-S的键长。
(2)S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,。根据价层电子对互斥理论可知,S原子的孤对电子对数=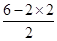 =1,价层电子对数=2+1=3,故二氧化硫为V形,S原子形成sp2杂化。
=1,价层电子对数=2+1=3,故二氧化硫为V形,S原子形成sp2杂化。
(3)非金属性越强,氢化物的稳定性越强。非金属性F>Cl>S,因此氢化物稳定性是HF>HCl>H2S;氟化氢分子之间存在氢键,沸点最高,氯化氢与硫化氢都形成分子晶体,HCl的相对分子质量大,沸点比硫化氢高,故沸点由高到低的顺序为HF>HCl>H2S。
(4)S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应过程中硫元素一部分升高到+4价(生成SO2),一部分降低到0价(生成S),由原子守恒可知还生成水,所以根据电子得失守恒可知反应方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl。
考点:考查电子式书写、化学键、分子结构、杂化轨道判断以及元素周期律的应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
过氧化氢(H2O2)俗称双氧水,外观为无色透明液体,是一种强氧化剂,适用于伤口及环境、食品消毒;实验室一般用过氧化钡(BaO2)与稀硫酸反应来制取。请问,过氧化钡(BaO2)中所含化学键为
| A.只有离子键 | B.离子键和共价键 |
| C.只有共价键 | D.离子键、共价键和氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的原子外围电子构型为ns2npn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38∶77,据上可推知:
(1)X________,Y________,Z________(写元素符号)。
(2)X2Y2是________晶体,构成晶体的微粒是________,该晶体中含有________(填其微粒间作用)。
(3)Z的硫化物和氯化物的分子空间构型分别是__________、________,其中Z原子分别以________、________杂化轨道成键,按照成键方式来分类,Z的硫化物中的共价键类型和数目是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CS2和S2Cl2都是硫的重要化合物,在工业上有广泛的用途。二者的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·cm—3[来源 | 水 |
| CS2 | —110.8 | 46.5 | 1.26 | 难溶 |
| S2Cl2 | —76 | 138 | 1.75 | 水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列五种物质中①Ne ②H2O ③NH3④KOH ⑤Na2O,只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 。(填写序号)
(2)在下列变化中,①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水⑤O2溶于水,未发生化学键破坏的是 ,仅发生离子键破坏的是 ,仅发生共价键破坏的是 。(填写序号)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【选修3物质结构与性质】(15分)
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离
子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 ;
(4)H2Se的酸性比H2S (填“强”或“弱”)。气态SeO3分子的立体构型
为 ,SO32-离子的立体构型为 ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,
K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
;
② H2SeO4比 H2SeO3酸性强的原因:
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为 (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为 pm(列示表示)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下面有关晶体的叙述中,不正确的是
| A.氯化钠晶体中,每个Na+周围紧邻6个Cl- |
| B.氯化铯晶体中,每个CS+周围紧邻8个Cl- |
| C.氟化钙晶胞中,每个F-周围紧邻8个Ca2+、每个Ca2+周围紧邻8个F- |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
最近,美国LawreceLiremore国家实验室(LLNL)的V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是
A.CO2的原子晶体中存在范德华力,每1molCO2原子晶体中含有2NA 键
键
B.在一定条件下,CO2原子晶体转化为分子晶体CO2是物理变化
C.熔点:金刚石>氯化钠>原子晶体CO2
D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在纳米级的空间中,水的结冰温度是怎样的呢?为此,科学家对不同直径碳纳米管中水的结冰温度进行分析。下图是四种不同直径碳纳米管中的冰柱结构及结冰温度,冰柱的大小取决于碳纳米管的直径。水在碳纳米管中结冰的规律是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com