
����Ŀ��һ�������£���CO2��H2�Ʊ��״��Ĺ����к������з�Ӧ��
��Ӧ1:CO2(g)��H2(g)![]() CO(g)��H2O(g) ��H1
CO(g)��H2O(g) ��H1
��Ӧ2:CO(g)��2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
��Ӧ3:CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H3
CH3OH(g)��H2O(g) ��H3
���Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2��K3���������¶ȱ仯��������ͼl��ʾ����Ӧ1��3�Ļ����ͼ2��ʾ��
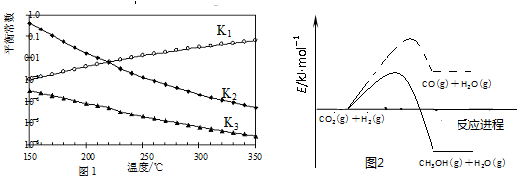
��1������H2________��H3(����������������������������)��������________��
��2����Ӧ1����S1______0(�������)��ָ���������Է����е��¶�����____(�����ϸ��¶��������ϵ��¶���)
��3���������Ϊ1:1��H2��CO2�����ݻ��ɱ��ܱ������ڣ���ֻ���з�Ӧ1�����д�ʩ����ʹƽ��ʱ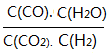 �������____________(�����)
�������____________(�����)
A�������¶�B������ѹǿC������һ������CO2 D���ټ���һ��������
��4��Ϊ�����CO2��H2�Ʊ��״�����Ч�ʺͲ�������ҵ������ͨ����ȡ����ʩ��____________
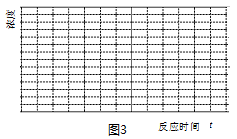
��5�����¶�Ϊ300��ʱ��ʹ���������������Ϊ��H2��CO2������㶨���ܱ������ڽ��з�Ӧ�����¶��·�Ӧ2���г̶Ⱥ�С�ɿ��ɲ����У�����ͼ3�л���CO��CH3OHŨ����ʱ��仯��ƽ��Ķ�������ͼ��
���𰸡���1��С�ڣ���ͼl��֪�������¶����ߣ�K1��������H1��0�����ݸ�˹���ɵ���H3����H1����H2��������H2����H3
��2�������ϸ��¶�
��3��A
��4��ʹ�ô�������ѹ��������Һ�����롢ԭ����ѭ������(���2�㼴��)
��5��
��������
�����������1����ͼl��֪�������¶����ߣ�K1������Ӧ1:CO2(g)+H2(g)![]() CO(g)+H2O(g)��H1��0����Ӧ3�ɷ�Ӧ1+2���ã����ݸ�˹���ɣ���H3=��H1+��H2��������H2����H3���ʴ�Ϊ��С�ڣ���ͼl��֪�������¶����ߣ�K1��������H1��0�����ݸ�˹�����ֵ���H3=��H1+��H2��������H2����H3��
CO(g)+H2O(g)��H1��0����Ӧ3�ɷ�Ӧ1+2���ã����ݸ�˹���ɣ���H3=��H1+��H2��������H2����H3���ʴ�Ϊ��С�ڣ���ͼl��֪�������¶����ߣ�K1��������H1��0�����ݸ�˹�����ֵ���H3=��H1+��H2��������H2����H3��
��2��������G=��H�CT��S����H��0���÷�Ӧ�ܹ�����������S��0�������ܷ�����Ҫʹ�÷�Ӧ�Է�������G��0�����T��ϸ��¶ȣ��ʴ�Ϊ�������ϸ��¶ȣ�
��3��A�������¶ȣ�ƽ�������ƶ���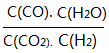 ������ȷ��B������ѹǿ��ƽ�ⲻ�ƶ���
������ȷ��B������ѹǿ��ƽ�ⲻ�ƶ��� ���䣬����C������һ������CO2�����¶Ȳ��䣬
���䣬����C������һ������CO2�����¶Ȳ��䣬 =K�����䣬����D���ټ���һ�������ۣ�ƽ�ⲻ�ƶ���
=K�����䣬����D���ټ���һ�������ۣ�ƽ�ⲻ�ƶ��� ���䣬����ѡA��
���䣬����ѡA��
��4��Ϊ�����CO2��H2�Ʊ��״�����Ч�ʺͲ�������ҵ������ͨ����ȡ����ʩ��ʹ�ô�������ѹ��������Һ�����롢ԭ����ѭ�����õȷ������ʴ�Ϊ��ʹ�ô�������ѹ��������Һ�����롢ԭ����ѭ�����õȣ�
��5�����¶�Ϊ300��ʱ��ʹ���������������Ϊ��H2��CO2������㶨���ܱ������ڽ��з�Ӧ�����¶��·�Ӧ2���г̶Ⱥ�С�ɿ��ɲ����У����ŷ�Ӧ�Ľ��У���Ӧ1�У�CO��Ũ��������Ӧ3��CH3OH��Ũ��������Ӧ1Ϊ���ȷ�Ӧ����Ӧ3Ϊ���ȷ�Ӧ����Ӧ���е�һ���̶ȣ���Ӧ3 �����ƶ���CH3OH��Ũ����С�����ﵽƽ�⣬CO��CH3OHŨ����ʱ��仯��ƽ��Ķ�������ͼΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��


 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���������ѧ�Һ�°���������ͼ���ĸ����Ĵ����������գ��������̱�ʾ���£�

![]()
��1���������з����Ļ�ѧ��Ӧ����ʽ��
________________________________________________________________________
________________________________________________________________________��
��2��д������������X���ʵķ���ʽ________��
��3��ʹԭ���Ȼ��Ƶ������ʴ�70%��ߵ�90%���ϣ���Ҫ�������________(�����������еı��)��ѭ�����ӳ�������ȡ�������IJ�����________��
��4��Ϊ�����Ʒ̼�������Ƿ����Ȼ��ƣ���ȡ������������ˮ���ٵμ�_______________________��
��5����ĸҺ��ͨ����������ϸСʳ�ο�������ȴ��������Ʒ��ͨ������������________(������ĸ)��
(a)����NH��Ũ�ȣ�ʹNH4Cl���������
(b)ʹNaHCO3���������
(c)ʹNaHCO3ת��ΪNa2CO3�����������NH4Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿������[Al(NO3)3]��һ�ֳ���ýȾ������ҵ��������(��Ҫ��Al��Al2O3��Fe2O3��)��ȡ����������[Al(NO3)3��9H2O]���������£�

��1��д����Ӧ�������ӷ���ʽ�� (��дһ��)��
��2������ʵ��������ɷ�Ӧ����Ϊ����������ʧ����Ҫ����������� ���ɲ�ȡ�Ĵ�ʩΪ ��
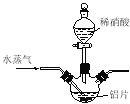
��3���¶ȸ���200��ʱ����������ȫ�ֽ������������������(�������Ϊ4:1)���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��4��������ͼ��ʾʵ��װ����ȡAl(NO3)3��ͨ��ˮ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɱ�ϩ�����з�Ӧ���Ƶ�F��G���ָ߷��ӻ�������Ƕ��dz��õ����ϡ���������E���緢������ţ���У������������Ǵ�л���м��壬�����������������۵ȷ����Ƶã�E�ĸ���������ϲ���IJ��Ƽ�֮һ��
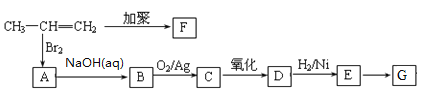
��֪��![]()
��1��D���������������ơ�E��G�ķ�Ӧ����Ϊ_________��
��2���ۺ���F�Ľṹ��ʽ���ۺ���G�Ľṹ��ʽ_________
��3����һ�������£�������E��Ũ�����������γ�һ����Ԫ��״������û�����Ľṹ��ʽ��_________��
��4��Bת��ΪC�Ļ�ѧ��Ӧ����ʽ��_________��
��5���������ֻ�������E��Ϊͬ���칹�����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
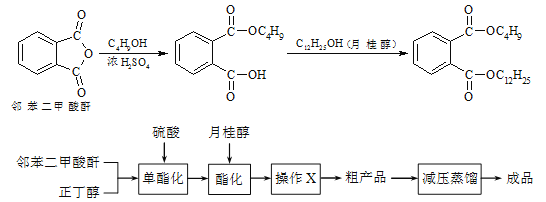
����Ŀ���ڱ������ᶡ���¹�����һ�ֵ���ɫ����״Һ�壬�ܶ�Լ0.97g/cm3��������������ϩ����֬�����ܼ�����ҵ������ԭ�������������£�
�й����ʵ��������ʼ��±���
������ | �ܽ��� | �۵� | �е� |
�ڱ��������� | ������ˮ�����ѣ��������ȱ����Ҵ������� | 131.6�� | 295�� |
������ | ����ˮ�������Ҵ����ѡ������л��ܼ� | -88.9�� | 117.5�� |
�¹� | ������ˮ�����ڴ����� | 24 | 259�� |
�ڱ������ᶡ���¹��� | ������ˮ�����ڶ����л��ܼ� | ���� | 202��210�� |
ijʵ��С���ͬѧģ�ҵ�����Ĺ������̣�����ͼ��ʾװ����ȡ�����ڱ������ᶡ���¹�����ͼ�мгֺͼ���װ������ȥ����Ҫ�����������£�
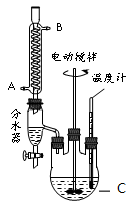
����������ƿ�ڼ���30 g �ڱ�����������16 g �������Լ�����Ũ���ᡣ
�����裬������105 �����������跴Ӧ1Сʱ��
����ȴ�����£�����40 g �¹�������160 �������衢��������Ӧ������
����ȴ�����£�����Ӧ����ﵹ����
��ͨ�����������еIJ���X���õ��ֲ�Ʒ��
��ش��������⣺
��1������C������___________������������ˮӦ��___________����
��2����������жϷ�Ӧ�ѽ����ķ�����___________��
��3��������в���X�ɳ�ȥ����δ��Ӧ���ڱ�����������������������X����___________��
��4�����������м�ѹ�����Ŀ����___________��
��5��ʵ������������ڡ��۲��ʶ��Ƚϸߣ�ԭ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к˵����С��20��Ԫ��A����������������£�(I1��ʾʧȥ��1�����ӵĵ����ܣ�In��ʾԭ��ʧȥ��n�����ӵĵ����ܣ���λ����102kJ��mol��1)
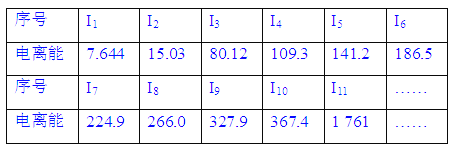
��1�����������ԽԶ������Խ�ߣ�������Խ__________(������������С��)�������ӵ����Խ�ߣ�ʧȥ����ʱ��������Խ________(������������С��)��
��2������11�����ӷ���________�����Ӳ㡣
��3��ʧȥ��11�����Ӻ�Ԫ�ػ���________�����ӡ�
��4����Ԫ������������Ӧˮ����Ļ�ѧʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������ε����Ҷ�С��36��A��B��C��D��E����Ԫ�أ�����A��һ�ֺ�����û�����ӣ�Bԭ�ӻ�̬ʱ���������������ڲ��������2����Dԭ�ӻ�̬ʱ2pԭ�ӹ������2��δ�ɶԵĵ��ӣ�EԪ�ص�ԭ�ӽṹ��3d�ܼ���δ�ɶԵ������dzɶԵ�������2�����ش��������⣺
��1��B2A4������Bԭ�ӹ�����ӻ�����Ϊ ��B2A4�����ЦҼ��ͦм�������Ϊ ��
��2��A��B��C��D����Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ______________����Ԫ�ط��ű�ʾ����������CA3�ķе�Ȼ�����BA4�ĸߣ�����Ҫԭ���� ��
��3��Ԫ��B��һ����������Ԫ��C��һ�������ﻥΪ�ȵ����壬Ԫ��C������������ķ���ʽ�� ��
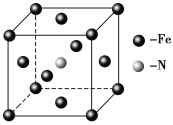
��4��Ԫ��E���γɶ��������磺E(CO)5�ȡ�
�ٻ�̬Eԭ�ӵļ۵����Ų�ͼΪ ��
��E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������� ��������ͣ����þ�����E�Ļ��ϼ�Ϊ ��
��5��E��C�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ����Ļ�ѧʽΪ_______�������������Eԭ�Ӽ�ľ���Ϊacm����þ�����ܶ���______g��mL-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2����������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ���2.18g/cm3���е�131.4�����۵�9.79����������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ���п�������ͼ��ʾװ���Ʊ�1��2���������������з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Ũ��ˮ�����渲������ˮ����
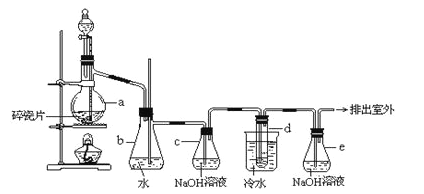
����д���пհף�
��1����ƿa�з��������Ҵ�����ˮ��Ӧ������ȥ��Ӧ����Ӧ�¶���170�������Ҹ÷�ӦҪ���¶�Ѹ�����ߵ�170������������������Ӧ����д���Ҵ�������ȥ��Ӧ�ķ���ʽ ��
��2��д���Ʊ�1��2����������Ļ�ѧ����ʽ�� ��
��3����ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������ش�������ʱƿb�е����� ��
��4������c��NaOH��Һ�������ǣ� ��
��5���жϸ��Ʊ���Ӧ�Ѿ��������������___________________________��
��6�������������������������ѣ�����__________�ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��d������ҪĿ����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��2��ѧ�뼼����
������Ȼ��ֲ��㷺���ڹ�ҵ��ũҵ�����Ƽ�������ҪӦ�á�
�ش��������⣺
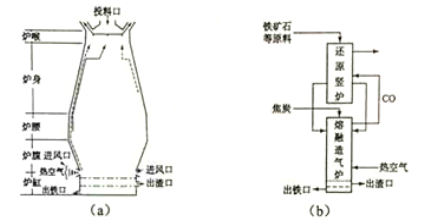
��1��������ʯ��������ұ�������ĸ�¯��ͼ��a����ʾ��ԭ���г�����ʯ�ͽ�̿�⺬�� ����ȥ����ʯ����ʯ����Ҫ�ɷ�ΪSiO2 ���Ļ�ѧ��Ӧ����ʽΪ �� ����¯�ų��������Ҫ�ɷ���N2��CO2 �� (�ѧʽ)��
��2����֪����Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ��H=+494kJ��mol-1
��CO(g)+O2(g)=CO2(g) ��H=-283kJ��mol-1
��C(s)+O2(g)=CO(g) ��H=-110kJ��mol-1
��ӦFe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) �Ħ�H= kJ��mol-1�������Ϸ�Ӧ �ų����������Թ�����Ӧ ���������������������ʽ�����
��3��������Ƴ����������ڻ�ԭ�����������գ���������ͼ(b)��ʾ�����У���ԭ��¯�൱�ڸ�¯��
���֣���Ҫ��Ӧ�Ļ�ѧ����ʽΪ ����������¯�൱�ڸ�¯�� ���֡�
��4������ʯ�г�������ʹ��¯���л���SO2 ��Ⱦ��������SO2 �ķ����� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com