
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 |
|
|
|
|
③ |
| 298 | 10 | 6.0 | 0.30 |
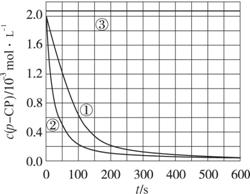
[数据处理]实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应在50~150 s内的反应速率:
v(p-CP)=_____________ mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:______________________________。
(4)实验③得出的结论是:pH等于10时,______________________________________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________________________________________。
(1)
实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
H2O2 | Fe2+ | ||||
① |
|
|
|
|
|
② |
| 313 | 3 | 6.0 | 0.30 |
③ | 探究溶液的pH对降解反应速率的影响 |
|
|
|
|
(2)8.0×10-6
(3)过氧化氢在温度过高时迅速分解
(4)反应速率趋向于零(或该降解反应趋于停止)
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)
解析:该题为信息型(文字、图表提供信息)的实验探究题,仔细阅读题目信息,明确实验目的,该题还是比较容易作答的。
(1)②的实验目的为“探究温度对降解反应速率的影响”,很显然就要固定其他变量〔pH、c(H2O2)、c(Fe2+)〕,而只改变温度——题目中已给的另一个恒定温度313 K。第③组实验的变量是pH,其他条件未变,显然实验目的是:探究溶液的pH对降解反应速率的影响。
(2)根据图中实验①曲线,该降解反应在50~150 s内的反应速率为:
![]()
(3)温度过高时,导致降解反应速率减小,从Fenton法所使用试剂H2O2的角度分析原因,就要联系H2O2的相关性质,再和“温度”这一因素联系起来,就不难得出“H2O2在温度过高时迅速分解,从而不能产生羟基自由基氧化降解污染物”的结论。(4)观察实验③的曲线,几乎是一条c(p-CP)不变的曲线,说明p-CP几乎没有被降解。所以当pH=10时反应速率趋向于零(或该降解反应趋于停止)。(5)该题承接第(4)题,根据题目信息,使该降解反应迅速停止反应的方法应是:将所取样品迅速加入到一定量的碱性溶液中,并控制溶液的pH=10。


科目:高中化学 来源: 题型:阅读理解
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol.L-1 | |
| H2O | Fe2- | ||||
| (1) | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| (2) | 探究温度对降解反应速的影响率 | ||||
| (3) | 298 | 10 | 6.0 | 0.30 | |

查看答案和解析>>
科目:高中化学 来源: 题型:

 Fe(SCN)2+来检验反应是否产生铁离子.已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol?L-1,c(SCN-)=0.1mol?L-1,c[Fe(SCN)2+]=0.68mol?L-1.则此温度下该反应的平衡常数K=
Fe(SCN)2+来检验反应是否产生铁离子.已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol?L-1,c(SCN-)=0.1mol?L-1,c[Fe(SCN)2+]=0.68mol?L-1.则此温度下该反应的平衡常数K=查看答案和解析>>
科目:高中化学 来源: 题型:
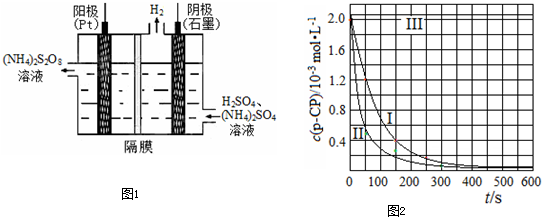
| 实验 编号 |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| Ⅰ | 298 | 3 | 6.0 | 0.30 |
| Ⅱ | 313 | 3 | 6.0 | 0.30 |
| Ⅲ | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
![]() Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和![]() 浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
![]() [实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
![]() (1)请完成以下实验设计表(表中不要留空格)。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验
| 实验目的 | T/K | PH | c/10-3mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ |
| 298 | 10 | 6.0 | 0.30 |
![]() [数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。

![]() (2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
![]()
![]() (p-CP)= mol·L-1·s-1
(p-CP)= mol·L-1·s-1
![]() [解释与结论]
[解释与结论]
![]() (3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
![]() (4)实验③得出的结论是:PH等于10时, 。
(4)实验③得出的结论是:PH等于10时, 。
![]() [思考与交流]
[思考与交流]
![]() (5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法: ![]()
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期期中考试化学试卷(解析版) 题型:实验题
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
|
实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |
【数据处理】实验测得p-CP的浓度随时间变化的关系如下图。

(2)请根据上图实验①曲线,计算降解反应在50~150s内的反应速率:
υ(p-CP)= mol·L-1·s-1
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
。
(4)实验③得出的结论是:pH等于10时, 。
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com