
| A. | 1:1:1 | B. | 1:3:3 | C. | 1:2:3 | D. | 2:3:3 |
分析 钠、铁、铝与足量盐酸反应,方程式:2Na+2HCl=2NaCl+H2↑、Fe+HCl=FeCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,根据金属的物质的量计算.
解答 解:等物质的量的钠、铁、铝分别与足量的盐酸充分反应,
设金属的物质的量均为1mol,
2Na+2HCl=2NaCl+H2↑、Fe+HCl=FeCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
1mol 0.5mol 1mol 1mol 1mol 1.5mol
故在相同条件下产生氢气的体积比=0.5mol:1mol:1.5mol=1:2:3,
故选C.
点评 本题考查根据方程式进行的计算,题目难度不大,掌握化学方程式基本计算方法是关键,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
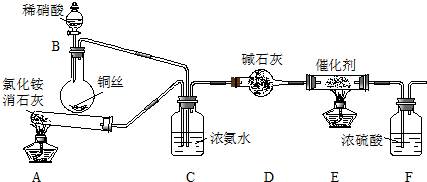
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
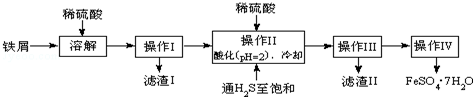
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | a |
| c(CO2) | 3 | 1 | 0.8 | 1 |
| c(H2) | 2 | 1 | 0.8 | 1 |
| c(CO) | 1 | 2 | 3 | 0.5 |
| c(H2O) | 2 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用NH4NO3晶体和Ca(OH)2固体加强热来实验时制取氨气 | |
| B. | 将乙醇和乙酸混合液加入到浓硫酸中加热制备乙酸乙酯 | |
| C. | 氯气泄漏用浸有肥皂水的湿毛巾捂住口鼻向高处转移 | |
| D. | 将储存钠的试剂瓶内加入CCl4液封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大 | |
| B. | 向NaF溶液中滴加硫酸至中性时,c(SO42-)<c(HF) | |
| C. | 向氨水中加入NH4C1固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| D. | AgCl在水和NaCl溶液中的溶度积分别为K1、K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
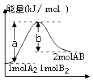
| A. | 该反应是放热反应 | |
| B. | 加入催化剂,(b-a)的差值减小 | |
| C. | 每生成2molAB分子吸收bkJ热量 | |
| D. | 若反应生成AB为液态,吸收的热量小于(a-b)kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com