
A,B,C是元素周期表中相邻的三种元素,A与B同周期,B与C同主族.此三种元素原子最外层电子数之和为17,质子数总和为31.则A,B,C分别是________.
|
【答案】N,O,S 【解析】这是一道考查原子结构与周期表位置关系的题目,要得出答案还需要进一步讨论或者估算.我们可以估出,三种元素质子数之和为31,则它们大致位置在短周期内,因为A与B同周期,B与C同主族,在周期表中的位置可能有以下四种排列方式.
设B的质子数为x,按①排列方式,A的质子数为(x-1),C的质子数为(x-8),质子数之和为x+(x-1)+(x-8)=31,解得x=40/3,非整数,不合理. 同理可按②~④排列方式建立下列关系式: ②x+(x+1)+(x-8)=31,解得x为非整数,不合理. ③x+(x+1)+(x+8)=31,解得x为非整数,不合理. ④x+(x-1)+(x+8)=31,解得x=8,由此推知A,B,C分别是氮、氧、硫,且它们的最外层电子数之和为5+6+6=17,符合题意. |
|
【方法提炼】这是一道推断题,推断题的通常做法是根据题目条件推导出可能的情况,再将各种情况代入已知条件,验证是否可行.做题时考虑要全面,如此题就是将元素周期表中的周期和族的位置关系以及质子数的关系结合起来,同学们既要考虑到这三种元素可能的位置关系,也要能正确表示每种元素的质子数. |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


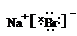
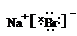
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com