
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
分析 (1)碳酸为二元弱酸,溶液中分步电离,电离平衡常数=$\frac{离子浓度积}{碳酸的浓度}$;
(2)电离平衡常数大小比较酸的强弱,酸越弱对应盐水解程度越大,以此解答该题;
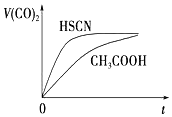
(3)由生成二氧化碳的曲线斜率可知HSCN反应较快,则可知HSCN中中c(H+)较大,说明HSCN酸性较强,再利用盐类水解的规律来分析离子浓度的关系;
(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中c(Na+)-c(CN-)可以依据电荷守恒计算得到,溶液中HCN的电离平衡常数计算得到比值;
(5)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸;
(6)醋酸钠水解离子方程式为CH3COO-+H2O=CH3COOH+OH-,设溶液中c(OH-)=xmol/L,CH3COONa水解程度很小,计算时可将CH3COO-的平衡浓度看成是CH3COONa溶液的浓度,所以该溶液水解平衡常数K=$\frac{c(O{H}^{-})c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{Kw}{Ka}$=$\frac{{x}^{2}}{0.18}$=$\frac{1{0}^{-14}}{1..8×1{0}^{-5}}$,x=10-5,溶液中c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,pH=-lgc(H+).
解答 解:(1)碳酸为二元弱酸,溶液中分步电离,H2CO3?HCO3-+H+,HCO3-?H++CO32-,一级电离平衡常数表达式:Ka1=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$,
故答案为:$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$;
(2)物质的量浓度均为0.1mol/L的六种溶液:a.CH3COONa、b.Na2CO3、c.NaClO、d.NaHCO3、e.NaSCN f.NaCN,由电离平衡常数大小比较得到酸性,
HSCN>CH3COOH>H2CO3>HClO>HCN>HCO3-,则盐溶液的水解程度NaSCN<CH3COONa<NaHCO3<NaClO<NaCN<Na2CO3 ,pH由大到小的顺序为:b>f>c>d>a>e,
故答案为:b>f>c>d>a>e;
(3)由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)<c(SCN-),
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,溶液中c(H+)=10-8mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L,溶液中存在电荷守恒:c(Na+)+c(H+)=c(CN-)+c(OH-),则溶液中c(Na+)-c(CN-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L,NaCN与HCN的混合溶液中HCN存在电离平衡:HCN?H++CN-,K=$\frac{c({H}^{+})c(C{N}^{-})}{c(HCN)}$=6.2×10-10,得到$\frac{c(C{N}^{-})}{c(HCN)}$=$\frac{6.2×1{0}^{-10}}{1{0}^{-8}}$
故答案为:10-6-10-8;$\frac{6.2×1{0}^{-10}}{1{0}^{-8}}$;
(5)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,
故答案为:ClO-+CO2+H2O═HClO+HCO3-;
(6)醋酸钠水解离子方程式为CH3COO-+H2O=CH3COOH+OH-,设溶液中c(OH-)=xmol/L,CH3COONa水解程度很小,计算时可将CH3COO-的平衡浓度看成是CH3COONa溶液的浓度,所以该溶液水解平衡常数K=$\frac{c(O{H}^{-})c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{Kw}{Ka}$=$\frac{{x}^{2}}{0.18}$=$\frac{1{0}^{-14}}{1..8×1{0}^{-5}}$,x=10-5,溶液中c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,pH=-lgc(H+)=9.
故答案为:9.
点评 本题以弱电解质的电离为载体考查了离子方程式的书写、酸性强弱判断,根据电离平衡常数确定酸性强弱,再结合强酸制取弱酸来分析解答,物质的量不同导致其反应方程式不同,为易错点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电泳现象可说明胶体带电荷 | |
| B. | 胶体粒子很小,可以透过半透膜 | |
| C. | 直径在1-100nm之间的粒子称为胶体 | |
| D. | 是否具有丁达尔效应是溶液与胶体的本质区别 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ③⑤⑥⑧ | C. | ③⑤⑥⑦ | D. | ④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水除去Cl2中的HCl气体 | |
| B. | 用饱和碳酸氢钠溶液除去CO2中HCl气体 | |
| C. | 用Mg(OH)2除去MgCl2溶液中的少量FeCl3 | |
| D. | 用BaCl2溶液除去KNO3溶液中少量K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com