
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题。
(Ⅰ)下列一组有水参与的反应
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
⑤2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是_____________(填编号)。
(2)在这些氧化还原反应中,水既作氧化剂,又作还原剂是___________(填编号),水既不作氧化剂,又不作还原剂是__________(填编号)。
(3)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?___________(填“是”或“不是”),若是,这个反应的氧化剂和还原剂的质量比是________;
(Ⅱ)写出下列反应的离子方程式
①铜片与稀硝酸的反应_____________________________________;
②往氯化铝溶液中加入过量的NaOH溶液______________________;
(Ⅲ)写出下列反应的化学方程式
①二氧化硫发生催化氧化反应_________________________________;
②制漂白液的反应____________________________。
【答案】③ ⑤ ② 是 1:2 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O Al3++4OH-=AlO2-+2H2O 2SO2+O2![]() 2SO3 Cl2+2NaOH=NaCl+NaClO+H2O
2SO3 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(Ⅰ)(1)根据反应中是否有化合价变化分析是否为氧化还原反应;
(2)根据反应中水中是否有化合价升高和降低进行分析;
(3)根据反应中是否有元素化合价变化分析。
(Ⅱ)根据离子方程式书写的原则进行书写,注意量的关系。
(Ⅲ)根据二氧化硫和氧气反应生成三氧化硫书写反应方程式。根据氯气和氢氧化钠反应生成漂白液进行书写。
(1)只有③中没有元素化合价变化,不属于氧化还原反应;
(2)⑤中水中的氢元素化合价降低,氧元素化合价升高,所以是水既是氧化剂又是还原剂;②是水中的元素没有化合价变化,不是氧化剂也不是还原剂。
(3)3NO2+H2O=2HNO3+NO中氮元素化合价有升高和降低,是氧化还原反应,其中1mol二氧化氮做氧化剂的同时有2mol二氧化氮做还原剂,故比例为1:2;
(Ⅱ)①铜和稀硝酸反应生成硝酸铜、一氧化碳和水,离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②氯化铝和过量的氢氧化钠反应生成偏铝酸钠、氯化钠和水,离子方程式为:Al3++4OH-=AlO2-+2H2O;
(Ⅲ)①二氧化硫和氧气反应生成三氧化硫,方程式为:2SO2+O2![]() 2SO3;
2SO3;
②氯气和氢氧化钠溶液反应生成漂白液,方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。


科目:高中化学 来源: 题型:
【题目】碳热还原法广泛用于合金及材料的制备。回答下列问题
(1) 一种制备氮氧化铝的反应原理为23Al2O3+ 15C+5N2=2Al23O27N5+15CO,产物Al23O27N5 中氮的化合价为_____,该反应中每生成 l mol Al23O27N5转移的电子数为_______________ 。
(2) 真空碳热冶铝法包含很多反应.其中的三个反应如下:
Al2O3 (s) +3C(s)=Al2OC(s) +2CO(g) △H1
2Al2OC(s)+3C(s)=Al4C3(s)+2CO(g) △H2
2Al2O3(s) +9C(s)= Al4C3(s)+6CO(g) △H3
①△H3=________ ( 用△H1、△H2表示).
②Al4C3可与足量盐酸反应制备简单的烃。该反应的化学方程式为____________。
(3)下列是碳热还原制锰合金的三个反应 ,CO与CO2平衡分压比的自然对数(![]() ) 与温度的关系如图所示(已知Kp 是用平衡分压代替浓度计算所得的平衡常数,分压=总压 × 气体的物质的量分数)。
) 与温度的关系如图所示(已知Kp 是用平衡分压代替浓度计算所得的平衡常数,分压=总压 × 气体的物质的量分数)。

I. Mn3C(s)+4CO2(g) 3MnO(s)+ 5CO(g) Kp(I)
II. Mn(s) +CO2(g) MnO(s) +CO(g) Kp (II)
III. Mn3C(s)+CO2(g) 3Mn(s) +2CO(g) Kp(III)
①△H>O的 反应是_________ (填“I ”“II” 或“III”)。
②1200K时在 一体积为 2L 的恒容密闭容器中有17.7gMn3C( s)和0.4molCO2 ,只发生反应I,5min后达到平衡,此时CO的浓度为0.125mol/L,则0~5 min内 v(CO2)=_______。
③在一体积可变的密闭容器中加入一定量的Mn(s )并充入一定量的CO2(g) .只发生反应
II,下列能说明反应II 达到平衡状态的是________ (填标号)。
A. 容器的体积不再改变
B.固体的质量不再改变
C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.l molCO2, 若只发生反应III. 则在A点反应达到平衡时,容器的总压为akPa, CO2的转化率为______; A点对应温度下的Kp(III) =______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A.1mol![]() 参加反应,转移2mol电子
参加反应,转移2mol电子
B.![]() 在反应中被氧化
在反应中被氧化
C.![]() 的还原性强于ClO2
的还原性强于ClO2
D.CO2是![]() 被氧化后得到的产物
被氧化后得到的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
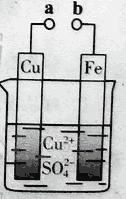
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋及其化合物在冶金、医疗、化工生产中均有重要作用。铋在自然界中的含量极少,常以游离金属和矿物的形式存在。对浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2、Cu2S、FeS2等杂质)通过浸出、净化和电沉积法分离回收铋的流程:

已知:I.“氯化浸出”过程中,需分批多次加入NaC1O3,以防生成Cl2;
II.BiCl3极易水解生成不溶性的BiOCl沉淀,但在浓盐酸中几乎不水解;
III.氧化性:Fe3+>Cu2+>Bi3+>H+.
请回答以下问题:
(1)“氯化浸出”时,为了提高浸取速率,可采取的措施有________________(任写一条);加入过量盐酸的主要目的是______________________.
(2)浸出渣中含有S和____________(写化学式);浸出液中所含的金属阳离子有Na+、Bi3+及___________________.
(3)写出“氯化浸出”中Bi2S3所发生反应的离子方程式__________________________.
(4)“还原”过程中所发生反应的离子方程式为2Bi+3Cu2+=2Bi3++3Cu及____________。
(5)“电解”过程的简易装置如图所示。装置中N为电源的______________(填“正”或“负”)极;阳极上发生的主要电极反应式为__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:C(金刚石,s)+O2(g)=CO2(g) △H1 ;
C(石墨,s)+O2(g)=CO2(g) △H2;
C(石墨,s)=C(金刚石,s)△H3=+1.9kJ/mol 下列说法正确的是
A. 金刚石比石墨稳定 B. △H1 > △H2
C. △H3=△H1 -△H2 D. 石墨转化成金刚石的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。

(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com