
| A. | 增大压强能缩短碘化氢分解反应达到平衡的时间 | |
| B. | 配制硫酸铁溶液时,向溶液中加入少量硫酸 | |
| C. | 往醋酸溶液中加碱溶液,使c(CH3COO-) 增大 | |
| D. | 向水中加入酸可抑制水的电离 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解;A、碘化氢分解两边的计量数相等,增大压强,加快反应速度,缩短反应达平衡所需时间,但平衡不移动,不能用勒夏特列原理解释,故A选;
B、铁离子水解容易生成氢氧化铁,加入稀硫酸防止其水解,能用勒夏特列原理解释,故B不选;
C、醋酸溶液中存在CH3COOH?CH3COO-+H+,向体系中加碱溶液,氢离子浓度减小,平衡正向移动,使c(CH3COO-)增大,能用勒夏特列原理解释,故C不选;
D、水电离产生氢离子和氢氧根离子,加入酸氢离子浓度变大,平衡逆向移动可抑制水的电离,能用勒夏特列原理解释,故D不选;
故选A.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
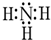 ,分子间存在氢键.
,分子间存在氢键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
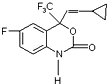 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )| A. | 该物质易溶于水 | |
| B. | M能发生缩聚反应 | |
| C. | M分子内至少有15个原子在同一个平面上 | |
| D. | M的分子式为C13H22O2NF4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:F-<Cl-<Br-<I- | B. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | ||
| C. | 氢化物稳定性:H2S>HF>H2O | D. | 酸性:HClO4>H3PO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 L庚烷完全燃烧所生成的气态分子数不是$\frac{7}{22.4}$NA | |
| B. | 28 g丙烯中含有的共用电子对数为6NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阿司匹林的分子式为C9H10O4 | B. | 阿司匹林属于有机高分子化合物 | ||
| C. | 1mol阿司匹林最多能与5molH2加成 | D. | 阿司匹林具有酸性,能与NaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com