
(13分)氧化还原反应在工农业生产和日常生活中有广泛运用。
(1)罐头厂在装食物罐头时通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类防腐剂应具有 。 (填“氧化性”或“还原性”);
(2)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是 。(填“氧化作用”或“还原作用”);
(3)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
(4)在下列的空白处填写最适宜的除杂试剂,并写出相应的离子方程式
① FeCl2中含少量FeCl3杂质 , 。
② FeCl3中含少量FeCl2杂质 , 。
③ FeSO4中含少量CuSO4 杂质 , 。
(1)还原性(1分) (2)还原作用(1分)(3) 防止Fe2+被氧化(2分) (4)① Fe(1分) ,2Fe3++Fe=3Fe2+ (2分) ② Cl2(1分) 2Fe2++Cl2=2Fe3++2Cl- (2分) ③ Fe(1分), Cu2++Fe=Fe2++Cu (2分)
【解析】
试题分析:(1)防止食品被氧化应该加入有还原性的物质。(2)Fe3+转化为Fe2+,化合价降低Fe3+表现出氧化性,维生素C就表现出还原性。(3)Fe2+有还原性,容易被空气中的氧气氧化,所以外表包的糖衣的作用是防止Fe2+被氧化。(4)① 除去FeCl2中含少量FeCl3杂质又要不引入新的杂质,加入铁粉,将FeCl3还原成FeCl2,发生反应为:2Fe3++Fe=3Fe2+② 除去FeCl3中含少量FeCl2杂质又要不引入新的杂质应该通入Cl2将FeCl2氧化成FeCl3,反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-③ 除去FeSO4中含少量CuSO4 杂质,需要把Cu2+置换出来,加入铁粉,反应的离子方程式为:Cu2++Fe=Fe2++Cu
考点:氧化还原反应的应用。


科目:高中化学 来源:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷(解析版) 题型:填空题
(12分)黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1)利用黄铜矿冶炼铜的反应为8CuFeS2+21O2 Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
①反应中被还原的元素是________(填元素符号),
②生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用过量稀盐酸浸取炉渣,过滤。
②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
①所选试剂为_
②证明炉渣中含有FeO的实验现象为
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中存在Fe3+和Fe2+ B.1.12L气体是NO、NO2的混合气体
C.反应后溶液中c(NO3-)=0.85mol/L D.反应后的溶液最多还能溶解1.4gFe
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
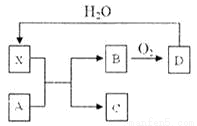
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D.工业上,B转化为D的反应条件为450℃、常压、使用催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关,下列有关说法正确的是
A.工业上以氯气和澄清石灰水为原料制造漂白粉
B.在制作印刷电路板的过程中常利用铁和氯化铜溶液的反应
C.二氧化硫的大量排放是造成光化学烟雾的主要原因
D.工业上可利用铝热反应原理制备某些高熔点金属,也可用于焊接铁轨
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),生成物并不改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.NaAlO2和HCl
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列几种物质的保存方法中,不正确的是
A.氯化铁溶液保存时加入少量的盐酸
B.氯水保存在棕色瓶里并放在冷暗处
C.漂白粉可以在敞口容器中长期存放
D.溴水盛放在有玻璃塞的细口瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:填空题
(22分)如下图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
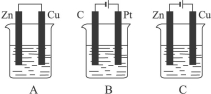
(1)A、B、C三个装置中属于原电池的是_____________。
(2)A池中Zn是_____________极, Cu极发生_____________反应,电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
(3)B池中C棒发生_________反应,电极反应为_________。B 池中的总反应为_ __。
(4)C池中Zn极的反应现象为 _____________。Cu极电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
已知下列数据:Fe(s) + 1/2O2(g) = FeO(s) ΔH=-272kJ/mol;2Al(s) + 3/2O2(g) = Al2O3(s) ΔH=-1675kJ/mol;则2Al(s) + 3FeO(s) = Al2O3(s) + 3Fe(s)的ΔH是
A.-859 kJ/mol B.+859 kJ/mol C.-1403 kJ/mol D.-2491 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com