
| A. | Q2>Q1>57.3 | B. | Q1=57.3<Q2 | C. | Q2>57.3>Q1 | D. | Q2=57.3>Q1 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
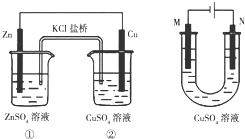
| A. | 装置①将电能转变为化学能 | |
| B. | 装置①中盐桥内的Cl-移向ZnSO4溶液 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中的Cu2+浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥① | B. | ③④②⑤① | C. | ③②④⑥⑤① | D. | ④③⑥⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | 金属元素的最外层电子数都小于4 | |
| C. | 已知硒(Se)位于第四周期第ⅥA族,其最高价氧化物对应水化物的化学式为H2SeO3 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若用标准盐酸滴定待测 NaOH 溶液,滴定前仰视,滴定后俯视则测定值偏大 | |
| B. | 可用 pH 试纸测定新制氯水的 pH | |
| C. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| D. | 向白色 ZnS 沉淀上滴加 CuSO4溶液,沉淀变为黑色,说明 Ksp(ZnS)<Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多 | |
| D. | 等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素肯定是金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com