
(本题16分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下:

(1)氯化炉中通入O2的目的是 _________。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是____________________________。
(3)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式___________________________________________________。
(4)在升华器中加入铝粉的目的是_________________________________________。
(5)用氯化铝晶体(AlCl3·6H2O)在HCl气中加热也能进行无水氯化铝的制备。但若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
(6)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为___________________________________。
(1)与C反应,提供反应所需的热量 (2分)
(2)Al2O3+3Cl2+3C = 2AlCl3+3CO (800 ℃)(3分)
(3)SO32-+Cl2+H2O=SO42-+2H++2Cl- (3分)
(4)将FeCl3杂质还原成Fe除去 (2分)
(5)4 (3分)
(6)Al-3e-+4Cl-= AlCl4-(3分)
【解析】
试题分析:工艺流程题要弄清原料及成分、所要制备的产品,给出的已知条件也是常设问题的地方要十分注意。
(1)通入氧气的目的,通氧气后出来的产物就可以知道是和碳反应,除此以外就是反应放热为其它反应提供能量。
(2)根据箭头的指向,C被还原成CO,氯气被还原成AlCl3,所以C+Al2O3+Cl2→CO+AlCl3
然后再利用氧化还原反应的配平方法进行配平。
(3)利用的是亚硫酸钠的还原性,氯气的氧化性,在溶液中亚硫酸根被氧化后生成硫酸根离子,氯气单质被还原后则是氯离子,写方程式时可以先写SO2+ Cl2→2Cl—+SO42—再根据电原子守恒和电荷守恒,在边补上水,右边补上氢离子,配平就可以了。
(4)由“升华器”处可知,要将铁元素除去,结合题意可知将FeCl3杂质还原成Fe除去。
(5)由2(AlCl3·6H2O)转化成Al2(OH)nCl(6-n)可知,
2×(27+35.5×3+6×18)×40%=27×2+17n+35.5×(6-n),求得n=4
(6)先写Al-3e- →AlCl4-,根椐原子守恒和电荷守恒补齐就行。
考点:氧化还原反应、离子反应方程式书写、电化学、与守恒法有关的计算。


科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
影响化学反应速率与平衡的因素有多方面,如浓度压强温度催化剂等。下列有关说法不正确的是
A.其它条件不变时,改变压强能改变气体反应的速率,但不一定改变平衡
B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数
C.温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数
D.加入催化剂能降低反应所需的活化能,使反应速率加快,平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
除去氯气中混有的少量的氯化氢气体,最好选用
A.水 B.饱和食盐水
C.纯碱溶液 D.饱和烧碱溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:推断题
(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下:
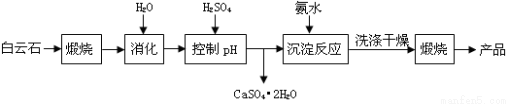
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石 。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 (填序号)。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:

①pH过高会导致___________________________下降,其原因是_______________________
②pH过低会引起____________________________ ,其原因可能是__________(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质 B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
根据上表数据,简要说明析出CaSO4.2H2O的操作步骤是 、 。
(4)写出沉淀反应中的离子方程式: 。
(5)该生产流程中还可得到的一种副产品是_______________。
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,
向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的
颜色为 (25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)。
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ均正确且有因果关系的是:( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 动物油脂相对不容易被氧化 | 油脂工业通常要将液态油脂氢化 |
B | HNO3具有酸的通性 | 硝酸常用作金属铜加工前的酸洗 |
C | 明矾可以净水 | 浑浊的石灰水加入明矾会变澄清 |
D | Si是一种非金属单质 | 单质Si能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高考预测理综化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.钢铁在潮湿的空气中比在干燥空气中更容易生锈
B.粗铜精炼时,电解液中的c(Cu2+)保持不变
C.配制溶液时俯视容量瓶刻度线定容会使溶液浓度偏高
D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高考预测理综化学试卷二(解析版) 题型:填空题
(本题16分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:
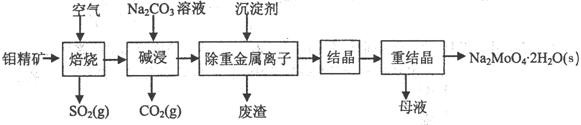 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
②____________________________
(2)写出焙烧时生成MoO3的化学方程式为:______________________________________
(3)写出“碱浸”反应的离子方程式:
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是 。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 ________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是 _________________________________________。
③若缓释剂钼酸钠—月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2  Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省江门市高二调研测试理综化学试卷(解析版) 题型:选择题
.某有机物的结构简式为CH3—CH2—CH=CH—CHO,下列关于该有机物的说法不正确的是
A.该有机物可与新制Cu(OH)2悬浊液反应
B.该有机物不能发生水解反应
C.该有机物的核磁共振氢谱图有5个波峰
D.该有机物不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.碳酸钙与稀硝酸反应: CaCO3+2H+ = Ca2++ CO2↑+H2O
B.金属钠与水反应: 2Na +2H2O =2Na+ +2OH-+ H2↑
C.铁溶于稀硫酸中: 2Fe+6H+ = 2Fe3++3H2↑
D.氢氧化钡溶液中滴加稀硫酸:Ba2+ + SO42-=BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com