
 2C(g)��5min��Ӧ�ﵽƽ��ʱn(A)Ϊ0.4 mol���ڷ�Ӧ��������ϵ���¶ȳ������ߣ�ʵ���û��������C�ĺ������¶ȵĹ�ϵ����ͼ��ʾ������������ȷ����
2C(g)��5min��Ӧ�ﵽƽ��ʱn(A)Ϊ0.4 mol���ڷ�Ӧ��������ϵ���¶ȳ������ߣ�ʵ���û��������C�ĺ������¶ȵĹ�ϵ����ͼ��ʾ������������ȷ���� 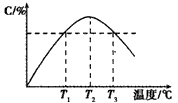

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Ե���Ϊ���ȣ�
��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Ե���Ϊ���ȣ�| ���� |
| �¶�/k CO2ת����/% n��H2��/n��CO2�� |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
![]() B��g��+C��g������H=a kJ/mol��a��0��
B��g��+C��g������H=a kJ/mol��a��0��
2 min��Ӧ��ƽ�⣬AΪ0.4 mol�����������в���ȷ����
A.B���ʵķ�Ӧ����Ϊ0.03 mol/��L��min��
B.��ַ�Ӧ��Ӧ���յ�����Ϊa kJ
C.��ƽ������¶Ⱥ�����������䣬�ٳ���1 molA��ƽ��������Ӧ�����ƶ�
D.���¶Ⱥ�����������䣬��ʼʱ����B��C��0.5 mol�����ƽ��ʱ��A�����ʵ�����Ϊ0.4 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ��н�ɽ��������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Ե���Ϊ���ȡ�
�ڴ��������£�CO2��H2������ȡ�״����Ҵ����磺2CO2(g)+6H2(g)
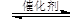 CH3CH2OH(g)+3H2O(g)
��
CH3CH2OH(g)+3H2O(g)
��
(��) ��һ��ѹǿ�£�����CO2��Ӧ��ȡ�Ҵ�����÷�Ӧ��ʵ���������±��������������ݻش��������⣺
|
|
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2.0 |
60 |
43 |
28 |
15 |
|
3.0 |
83 |
62 |
37 |
22 |
�¶����ߣ�ƽ�ⳣ��Kֵ�� �����������С�������䡱���������̼��[n(H2)/n(CO2)], ƽ�ⳣ��Kֵ�� �����������С�������䡱����
��600Kʱ��Ӧ�ﵽƽ�⣬Ҫʹ��ƽ�������ƶ���������������ʱ�����Բ�ȡ�Ĵ�ʩ��
������ţ���
A����С��Ӧ����� B��ͨ��CO2 C�������¶ȵ�800K D��ʹ�ú��ʵĴ���
����ij�¶��£������Ϊl L���ܱ������г���lmol CO2��4mol H2�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
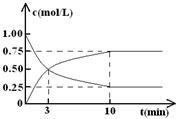
�ӷ�Ӧ��ʼ��ƽ�⣬�״���ƽ����Ӧ����v(CH3OH)= ��
������ƽ��Ũ��Ϊ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��8�֣�ij�¶��£������Ϊ2�̵������У��������������������ʵ�������ʱ��仯�Ĺ�ϵ��ͼ1��ʾ����2�����ã�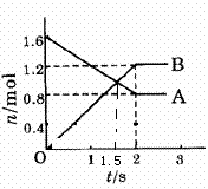
��Ũ�ȱ仯��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ _ __mol/(L?s) ���÷�Ӧ�Ļ�ѧ����ʽΪ____ ���÷�Ӧ�ﵽƽ��״̬��ʱ���ǵ� sʱ�����жϵ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com