
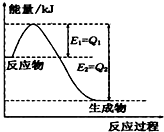
 ��1��һ�������£�N2��H2��Ӧ����lmolNH3�����������仯����ͼ��ʾ����1mol N2��ȫ��Ӧʱ���ʱ�Ϊ��
��1��һ�������£�N2��H2��Ӧ����lmolNH3�����������仯����ͼ��ʾ����1mol N2��ȫ��Ӧʱ���ʱ�Ϊ��| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| b |
| 2 |
| a |
| 2 |
| a |
| 2 |
| b |
| 2 |
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| ||||
|
| b��10-7 |
| a-b |
| b��10-7 |
| a-b |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
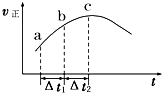 ����Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ���淴ӦSO2��g��+NO2��g��?SO3��g��+NO��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó���ȷ�Ľ����ǣ�������
����Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ���淴ӦSO2��g��+NO2��g��?SO3��g��+NO��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó���ȷ�Ľ����ǣ�������| A����Ӧ�� c ��ﵽƽ��״̬ |
| B����Ӧ��Ũ�ȣ�a ��С�� b �� |
| C����Ӧ�������������������������� |
| D����t1=��t2 ʱ��SO2 ��ת���ʣ�a��b ��С�� b��c �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ����̵�صķ�Ӧԭ��ʾ��ͼ�����е����KClO4���ڻ���л��ܼ��У�Li+ ͨ�������Ǩ����MnO2�����У��õ�LiMnO2���ش��������⣺
��ͼ����̵�صķ�Ӧԭ��ʾ��ͼ�����е����KClO4���ڻ���л��ܼ��У�Li+ ͨ�������Ǩ����MnO2�����У��õ�LiMnO2���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �̷� |
| H |
| ʯ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com