
 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:| 元素 | 性质或结构信息 |
| A | 单质为黄色粉末,难溶于水,能形成2种二元含氧酸 |
| B | M层有1个未成对的p电子,核外电子总数大于7 |
| C | 与锂形成的合金常用于航天飞行器,单质能溶于强酸和强碱 |
| D | S电子总数比p电子总数少2个,单质或氧化物均具有很高的熔、沸点 |
| E | 周期表中电负性最大的元素 |
| F | 最外层有2个电子,但次外层有18个电子 |
 .
. .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数). 分析 A单质常温下为固体,难溶于水易于溶CS2,能形成2种二元含氧酸,因此A为S;B原子的M层有1个未成对的p电子,核外p电子总数大于7,则B应该是Cl;C单质与锂形成的合金常用于航天飞行器,单质能溶强酸和强碱,所以C为Al;D原子核外电子层上s电子总数比p电子总数少2个,单质和氧化物均为空间网状晶体,具有很高的熔、沸点,则D为Si;E是周期表中电负性最大的元素是F,即E为F元素;F最外层有2个电子,但次外层有18个电子,则F的原子序数为30,为Zn元素,据此进行解答.
解答 解:A单质常温下为固体,难溶于水易于溶CS2,能形成2种二元含氧酸,因此A为S;B原子的M层有1个未成对的p电子,核外p电子总数大于7,则B应该是Cl;C单质与锂形成的合金常用于航天飞行器,单质能溶强酸和强碱,所以C为Al;D原子核外电子层上s电子总数比p电子总数少2个,单质和氧化物均为空间网状晶体,具有很高的熔、沸点,则D为Si;E是周期表中电负性最大的元素是F,即E为F元素;F最外层有2个电子,但次外层有18个电子,则F的原子序数为30,为Zn元素,
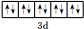
(1)A为S元素,S元素位于第三周期第ⅥA族,所以S原子的最外层电子排布式为:3s23p4;D为Si元素,Si元素的原子序数是14,核外电子数是14个,所以Si原子共有14种不同运动状态的电子;F离子为锌离子,其价层电子为3d轨道的10个电子,其价层电子的排布图为: ,
,
故答案为:3s23p4;14; ;
;
(2)非金属性越强,第一电离能越大,金属性越强,第一电离能越小,所以二者的第一电离能大小为:Si>Al,
故答案为:Si;Al;
(3)非金属性是S弱于Cl,所以两种元素的氢化物分子中键能较小的是H2S;非金属性越强,氢化物的稳定性越强,因此分子较稳定的是HCl,
故答案为:H2S;HCl;
(4)原电池中较活泼的金属做负极,镁的金属性强于Al,但由于铝能和氢氧化钠溶液,而镁不能,所以单质铝、镁、NaOH溶液构成的原电池中铝是负极,镁是正极,因此负极的电极反应式为:Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(5)A为S元素,其氢化物为H2S,H2S中O形成2个δ键,孤电子对数=$\frac{6-2×1}{2}$=2,所以S原子采用sp3杂化;
F为Zn,[F(NH3)4]2+为[Zn(NH3)4]2+,N原子和Zn原子之间存在配位键,NH3中H和N之间存在共价键,所以该阳离子中存在的化学键类型为共价键和配位键,
故答案为:sp3;共价键和配位键;
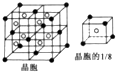
(6)E为F原子,根据晶胞的结构图并依据均摊原理可知,氟原子的个数为8,钙原子的个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个,因此该化合物的化学式为CaF2,含有离子键的离子化合物,因此其电子式为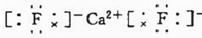 ;
;
已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,则该晶胞的体积是8×2.0×10-23cm3,
因此根据晶胞中钙离子的个数是4个可知:$\frac{ρ×8×2.0×1{0}^{-23}c{m}^{3}}{78g/mol}$×6.02×1023/mol=4,
解得:ρ=$\frac{78g/mol×4}{8×2.0×1{0}^{-23}×c{m}^{3}×6.02×1{0}^{23}/mol}$=3.2g/cm3,
故答案为: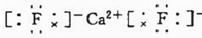 ;3.2g/cm3.
;3.2g/cm3.
点评 本题考查了位置、结构与性质关系的应用、晶胞的计算,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用基础知识的能力,注意熟练掌握原子结构与元素周期律、元素周期表的关系,(6)中的晶胞计算为难点,注意掌握晶胞计算的方法与技巧.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
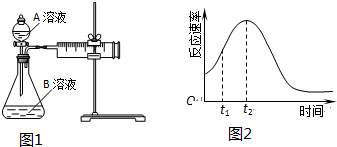
| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8+$\frac{1}{2}$ lg2 | B. | 9+lg2 | C. | 10+$\frac{1}{2}$ lg2 | D. | 11+2lg2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 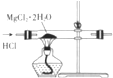 制取无水MgCl2 | B. |  除去CO2气体中的HCl气体 | ||
| C. | 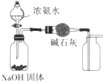 制取并收集干燥纯净的NH3 | D. | 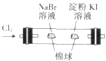 证明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.5mol/(L•min) | B. | x=3 | ||
| C. | B的转化率为25% | D. | 平衡时C的体积分数为28.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(CH3COO-)<c(Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=V╯(NH3) | B. | V(N2)=3V(H2) | ||
| C. | V(H2)=3/2V╯(NH3) | D. | N2,H2,NH3的体积比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
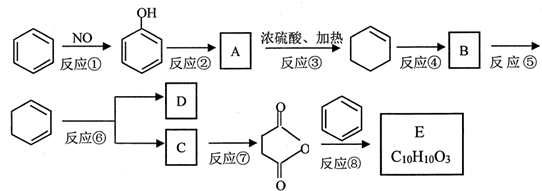
 +(CH3CO)2O→
+(CH3CO)2O→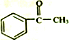 +CH3COOH
+CH3COOH ;B
;B .
. 直接制取
直接制取 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.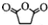 +
+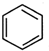 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$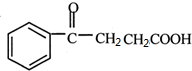 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com