
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下:
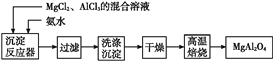
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为_____________。
(2)判断流程中沉淀是否洗净所用的试剂是__________________。
(3)在25 ℃下,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式:_____________。{已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34}。
(4)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
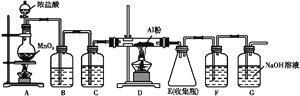
装置B中盛放饱和NaCl溶液,该装置的主要作用是______;F中试剂的作用是__________________________________________。
(5)将Mg、Cu组成的3.92 g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792 L(标准状况),向反应后的溶液中加入4 mol·L-1的NaOH溶液80 mL时金属离子恰好完全沉淀。则形成沉淀的质量为____g。
【答案】 2Al(OH)3+Mg(OH)2![]() MgAl2O4+4H2O AgNO3溶液(或硝酸酸化的AgNO3溶液) Al(OH)3 Al3++3NH3·H2OAl(OH)3↓+3NH4+ 除去HCl 吸收水蒸气 8.00
MgAl2O4+4H2O AgNO3溶液(或硝酸酸化的AgNO3溶液) Al(OH)3 Al3++3NH3·H2OAl(OH)3↓+3NH4+ 除去HCl 吸收水蒸气 8.00
【解析】试题分析:由制备MgAl2O4的主要流程可知,MgCl2、AlCl3的混合溶液与过量氨水反应后生成氢氧化镁和氢氧化铝沉淀,沉淀经洗涤、干燥、高温灼烧后得到产品。
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为2Al(OH)3+Mg(OH)2![]() MgAl2O4+4H2O。
MgAl2O4+4H2O。
(2)沉淀表面可能会吸附少量的氯离子和铵根,判断流程中沉淀是否洗净,可以检验洗涤液中是否有氯离子或铵根,由于氯离子的检验更简单、更灵敏,所以我们经常检验氯离子,所用的试剂是AgNO3溶液(或硝酸酸化的AgNO3溶液)。
(3)根据Ksp[Mg(OH)2]= c(Mg2+)c2(OH)=1.8×10-11,求得 c2(OH)= ![]() ,所以c(OH)=
,所以c(OH)= ![]() mol/L;由 Ksp[Al(OH)3]= c(Al3+) c3(OH)=3×10-34,求得c3(OH)=
mol/L;由 Ksp[Al(OH)3]= c(Al3+) c3(OH)=3×10-34,求得c3(OH)= ![]() ,所以c(OH)=
,所以c(OH)= ![]() 。比较两组数据可知,生成Al(OH)3沉淀所需要的OH浓度更小,所以先生成Al(OH)3沉淀。
。比较两组数据可知,生成Al(OH)3沉淀所需要的OH浓度更小,所以先生成Al(OH)3沉淀。
(4)由题意和装置图可知,该实验先用二氧化锰和浓盐酸反应制备氯气,这样制备的氯气中含有氯化氢和水蒸气,装置B中盛放饱和NaCl溶液,该装置的主要作用是除去HCl,C装置的作用是干燥氯气,D装置是制备氯化铝的装置,E装置收集氯化铝,F装置是保护装置,防止空气中的水蒸气进入E引起氯化铝水解,所以其中试剂的作用是吸收水蒸气,G装置吸收剩余的氯气,防止污染空气。
(5)将Mg、Cu组成的3.92 g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到NO气体1.792 L(标准状况下),则NO的物质的量为0.08mol,反应过程中的电子转移n(e-)=0.08mol![]() =0.24mol,金属离子恰好完全沉淀时生成氢氧化镁和氢氧化铜,沉淀的质量等于金属的质量加上其结合的氢氧根的质量,沉淀中n(OH-)= n(e-)=0.24mol,则形成沉淀的质量为3.92g+0.24mol
=0.24mol,金属离子恰好完全沉淀时生成氢氧化镁和氢氧化铜,沉淀的质量等于金属的质量加上其结合的氢氧根的质量,沉淀中n(OH-)= n(e-)=0.24mol,则形成沉淀的质量为3.92g+0.24mol![]() 17g/mol=8.00g。
17g/mol=8.00g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物改变的是( )
A. Fe 和HCl B. NaOH 和CO2 C. Na 和O2 D. AlCl3和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减。请回答:
(1)铁原子L能层上有__________种不同运动状态的电子,基态铁原子的外围电子排布式为_____________。
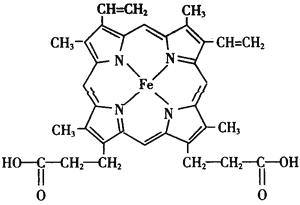
(2)血红素是血液的重要组成部分,其结构如图。其中C原子和N原子具有的相同的杂化方式为________________,N与Fe之间存在的相互作用是___________。血红素在人
体内合成时的基本原料之一是甘氨酸(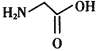 ),其分子中σ键和π键的个数比为___________。
),其分子中σ键和π键的个数比为___________。
(3)单质铁的某种晶体拥有体心立方晶胞,其配位数为___________,若其晶胞边长为a pm,其晶体密度为___________g/cm3(用含a的代数式表示,NA表示阿伏加德罗常数)。
(4)铁氰化钾(K3)俗称赤血盐,可用于检验Fe2+,反应的离子方程式为_____________。其配体的电子式为_______________,与其配体互为等电子体的微粒有_____________(任写两种,填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
已知:离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀).
A. ①和② B. ②和④ C. ③和④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与日常生活密切相关,下列说法错误的是
A.75%的乙醇溶液可杀菌消毒B.84 消毒液的有效成分是 Cl2
C.氢氟酸可刻蚀石英制艺术品D.装饰材料释放的甲醛会造成污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为2CO2(g) + 6H2(g)![]() CH3CH2OH(g) + 3H2O(g)。下列叙述正确的是
CH3CH2OH(g) + 3H2O(g)。下列叙述正确的是
A. 当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态
B. 当平衡向正反应方向移动时,平衡常数一定增大
C. 增大压强,可提高CO2和H2的转化率
D. 相同条件下,2 mol氢原子所具有的能量等于1 mol氢分子所具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)石墨电极(C)作________极,甲中甲烷燃料电池的负极反应式为______________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为________ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是________(填字母)。
A.a电极为纯铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是( )

A. 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
B. 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
C. 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
D. 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结论正确的是 ( )
①粒子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3;
③离子还原性:S2->Cl->Br->I-④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
A. ①④⑤ B. ③⑥ C. ②④⑤⑥ D. ①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com