
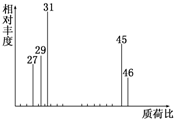
 为了测定某有机物A的结构,做如下实验:
为了测定某有机物A的结构,做如下实验:分析 (1)根据质荷比可知,有机物A的相对分子质量;
(2)根据n=$\frac{m}{M}$计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素,若含有氧元素,计算氧元素质量、氧原子物质的量,根据有机物A中C、H、O原子个数比值确定最简式;
(3)根据有机物的最简式中H原子说明是否饱和C原子的四价结构判断.
解答 解:(1)在A的质谱图中,最大质荷比为46,所以其相对分子质量也是46,故答案为:46;
(2)2.3 g该有机物中,n(C)=n(CO2)=0.1 mol,含有的碳原子的质量为m(C)=0.1 mol×12 g•mol-1=1.2 g,氢原子的物质的量为:n(H)=$\frac{2.7g}{18g/mol}$×2=0.3 mol,氢原子的质量为m(H)=0.3 mol×1 g•mol-1=0.3 g,该有机物中m(O)=2.3 g-1.2 g-0.3 g=0.8 g,氧元素的物质的量为n(O)=$\frac{0.8g}{16g/mol}$=0.05 mol,则n(C):n(H):n(O)=0.1 mol:0.3 mol:0.05 mol=2:6:1,所以A的实验式是C2H6O,
故答案为:C2H6O;
(3)该有机物的最简式为C2H6O,H原子已经饱和C原子的四价结构,最简式即为分子式,故答案为:能;C2H6O.
点评 本题考查有机物分子式与结构确定、同分异构体的书写等,难度中等,注意燃烧法利用原子守恒确定有机物的分子式,侧重对基础知识与学生综合能力考查,注意对有机谱图的简单认识.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 的分子式为C12H16O.
的分子式为C12H16O. 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个. 系统命名为4,4-二甲基-2-戊醇.
系统命名为4,4-二甲基-2-戊醇.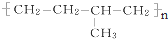 的单体为CH2=CH2、CH3-CH=CH2.
的单体为CH2=CH2、CH3-CH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |

| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
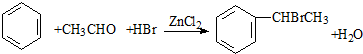 (卤烷基化反应)
(卤烷基化反应)
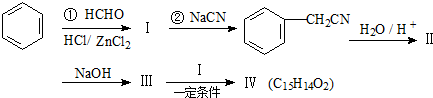
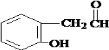 ,
,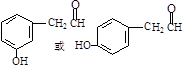 .
.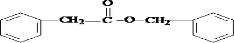 .
.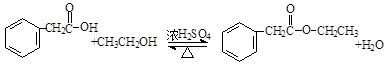 .
.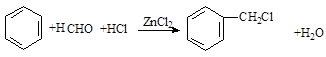 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①是非氧化还原反应,而②是氧化还原反应 | |
| B. | 上述反应中SO2的作用只相当于催化剂 | |
| C. | 反应②中CuSO4是氧化产物 | |
| D. | 反应①中SO2发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的金属性逐渐减弱 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为非电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | X元素的单质在化学反应中只表现还原性 | |
| C. | X、Y的简单离子半径Y>X | |
| D. | Y、Z、X的最高价氧化物均能与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com