
| A. | 10mL0.1mol/L的AlCl3溶液 | B. | 20mL0.2mol/L的CaCl2溶液 | ||
| C. | 30mL0.2mol/L的KCl溶液 | D. | 10mL0.25mol/L的NaCl溶液 |
分析 根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数,与溶液的体积无关.
解答 解:A.10mL0.1mol/L的AlCl3溶液,C(Cl-)=0.1mol/L×3=0.3mol/L;
B.20mL0.2mol/L的CaCl2溶液,C(Cl-)=0.2mol/L×2=0.4mol/L;
C.30mL0.2mol/L的KCl溶液,C(Cl-)=0.2mol/L×1=0.2mol/L;
D.10mL0.25mol/L的NaCl溶液,C(Cl-)=0.25mol/L×1=0.25mol/L;
所以氯离子浓度最大的是0.4mol/L;
故选:B.
点评 本题考查了物质的量浓度的有关计算,根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数来解答即可.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
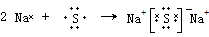 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2和盐酸; Cu(OH)2和CH3COOH | |
| B. | BaCl2和Na2SO4; Ba(OH)2和CuSO4 | |
| C. | NaHCO3和NaHSO4 Na2CO3和NaHSO4 | |
| D. | NaHCO3( 过量)和Ca(OH)2 Ca(HCO3)2 和NaOH( 过量) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:

(1)Ti元素原子序数为22,它在元素周期表中的位置是第 周期第 族;其基态原子的电子排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图1所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 。
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点﹣23.2℃,沸点136.2℃,所以TiCl4应是
化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图2所示,我们通常可以用图3所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请将其结构画出_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com