
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:MgO>NaCl>KCl | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
分析 A.同一主族元素氢化物相对分子质量越大,其熔沸点越高,但含有氢键的氢化物熔沸点最高;
B.离子晶体中电荷越多半径越小,熔点越高;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:A.同一主族元素氢化物相对分子质量越大,其熔沸点越高,但含有氢键的氢化物熔沸点最高,氨气中含有氢键,熔沸点最高,则熔沸点NH3>ASH3>PH3,故A错误;
B.电荷越多半径越小,熔点越高,晶体的熔点:MgO>NaCl>KCl,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,所以酸性:HClO4>H2SO4>H3PO4,故C正确;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性:Na>Mg>Al,碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确.
故选A.
点评 本题考查晶体熔沸点判断、氢化物的稳定性及最高价含氧酸强弱比较等等知识点,侧重考查学生分析判断及知识运用能力,注意氢键对物质物理性质的影响,氢键不影响化学性质,为易错点.


科目:高中化学 来源: 题型:解答题
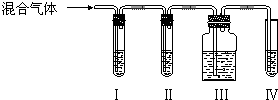
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.
表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
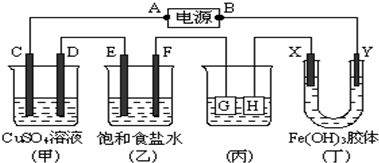
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
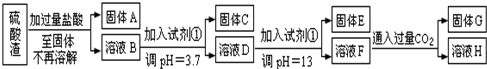
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 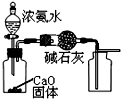 制取并收集干燥的NH3 | |
| B. | 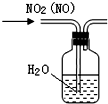 可除去NO2中的NO | |
| C. | 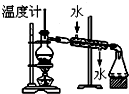 分离两种互溶但沸点相差较大的液体混合物 | |
| D. | 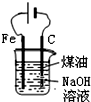 制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com