
【题目】下列能量转换过程与氧化还原反应有关的是
A. 白炽灯工作时,电能转化成光能
B. 酒精燃烧时,化学能转化为热能
C. 风力发电机工作时,风能转化为电能
D. 干电池工作时,化学能转化为电能
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价是____。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 g MoO3,反应中转移电子的数目为______。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是 (填序号)。
a. Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_______________________。
能提高该反应速率的措施有_______(填序号)。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式________________。
(6)已知钼酸钠溶液中c(![]() )=0.40 mol·L1,c(
)=0.40 mol·L1,c(![]() )=0.52 mol·L1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去
)=0.52 mol·L1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去![]() 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时,![]() 的去除率是_______。[已知Ksp(BaCO3)=2.6×109、Ksp(BaMoO4)=4.0×108,忽略溶液的体积变化]
的去除率是_______。[已知Ksp(BaCO3)=2.6×109、Ksp(BaMoO4)=4.0×108,忽略溶液的体积变化]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
反应原理:
反应物与产物的物理性质:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)实验过程中可能发生的有机副反应的方程式为________________________________。
(2)根据上述资料,装置__________最适宜用来完成本次制备实验。



A B C
(3)制备粗产品
将5 mL________加入试管A中,再加入l0 mL_______,摇匀后放入碎瓷片,缓慢加热至反应完全。
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等。粗产品需依次经过水洗,加碳酸钠溶液洗涤以及第二次水洗。在此过程中加入碳酸钠溶液的目的是_____________;分液时,环己烯应从分液漏斗的_____(填“上”或“下”)口取出。
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入右图所示装置的____________(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 。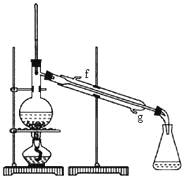
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式符合表述的是( )
A. 泡沫灭火器原理:3 CO32-+ 2Al3++3H2O=== 2Al(OH)3↓+ 3CO2↑
B. NaHCO3 溶液水解方程式:HCO3-+H2O![]() H3O++ CO32-
H3O++ CO32-
C. 酸性高锰酸钾溶液氧化草酸:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+ 8 H2O
D. 向苯酚钠溶液中通入少量的 CO2 气体![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化学基础】
工业制取高分子材料N和R的流程如下:

已知:
(1)步骤④的反应类型是________。
(2)D中官能团的名称是________。
(3)化合物A的结构简式是________。
(4)步骤③的化学方程式是 。
(5)符合下列条件的B的同分异构体有______ __种。写出其中核磁共振氢谱有6个峰,峰面积之比为3∶2∶2∶1∶1∶1的结构简式______ __。
a.苯环上只有两个对位取代基
b.能与FeCl3溶液发生显色反应
c.能发生水解反应
(6)利用以上合成路线的信息,请写出以丙酮(CH3COCH3)和乙二醇(HOCH2CH2OH)为原料合成软性隐形眼镜的单体甲基丙烯酸羟乙酯(CH2=C(CH3)COOCH2CH2OH)的合成路线(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的性质的叙述中,不正确的是( )
A. 苯是无色、带有特殊气味的液体
B. 常温下苯是不溶于水且密度小于水的液体
C. 苯在一定条件下能与溴发生取代反应
D. 苯不具有典型的双键所应具有的加成反应的性质,故不可能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雌黄 As2S3 和雄黄 As4S4 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有 抗病毒疗效也用来入药。
(1)砷元素有+2、+3 两种常见价态。雄黄在空气中加热至 300℃时会生成两种氧化物,其 中一种氧化物为剧毒的砒霜(As2O3),则物质 a 是_____,可用双氧水将 As2O3 氧化为 H3AsO4,写出该反应的化学方程式:________。

(2)亚砷酸 H3AsO3 可以用于治疗白血病,其在溶液中 存在多种微粒形态,25℃时,各种微粒物质的量分数与 溶液的 pH 关系如图所示。
①人体血液的 pH 在 7.35 ~7.45 之间,用药后人体中 含砷元素的主要微粒是_____。
②下列说法不正确的是_____(填字母序号)。
A.n(H3AsO3):n(H2AsO3-)=1:1 时,溶液显碱性
B.25℃时,H3AsO3 的第一电离平衡常数的值 Ka1=10-5
C.在 K3AsO3 溶液中, c(AsO33-)>c(HAsO32-)>c(H2AsO3-)
③将 KOH 溶液滴人亚砷酸溶液,当 pH 调至 11 时发生反应的离子方程式 是_____。
(3)P 和 As 属于同主族元素,存在亚磷酸(H3PO3),该酸与足量的 NaOH 溶液反应生成Na2HPO3。工业电解 Na2HPO3 溶液可得到亚磷酸,装置示意图如下:

①产品室中反应的离子方程式为_____;
②得到 1mol 亚磷酸的同时,阴极室制得 NaOH 质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,不正确的是
A. 用半透膜除去淀粉胶体中的Na+、Cl-
B. 胶体中分散质粒子的直径在1nm~100nm之间
C. 利用丁达尔效应可以区分溶液和胶体
D. 用滤纸能分离胶体和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com