
| A. | 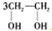 $\stackrel{催化剂}{→}$ $\stackrel{催化剂}{→}$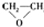 +HOCH2═O═CH2OH+2H2O +HOCH2═O═CH2OH+2H2O | B. | CH2═CH2+Cl2+Ca(OH)2?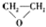 +CaCl2+H2O +CaCl2+H2O | ||
| C. | CH2═CH2+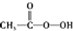 (过氧乙酸)? (过氧乙酸)?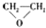 +C3HCOCH +C3HCOCH | D. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$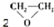 |
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水利用了胶体的性质 | |
| B. | 可用半透膜分离胶体和溶液 | |
| C. | 向Fe(OH)3胶体中加入硫酸钠,产生红褐色沉淀,属于化学变化 | |
| D. | 利用丁达尔现象可以区分胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据反应3NO2+H2O═2HNO3+NO可知,NO2是HNO3的酸酐 | |
| B. | 据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知浓HNO3的氧化性不如稀HNO3强 | |
| C. | 据反应2NO2(g)?N2O4(g)△<0可知要制得较纯净的NO2,需高温、低压环境 | |
| D. | NO2、Br2(g)同为红棕色气体,可用湿润的淀粉-KI试纸鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该未知物X为NaI | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为5:2 | |
| C. | 该反应中,发生氧化反应的过程是KIO3→I2 | |
| D. | 由反应可知还原性强弱顺序为:Na2SO3>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的碱性减弱,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗0.1molO2则阳极理论上生成0.2molCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请按要求回答下列问题.
请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
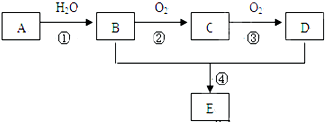
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中Cl-、N、Na+、S可以大量存在 | |
| B. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| C. | 向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色,说明原溶液中有I- | |
| D. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═S+2I-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
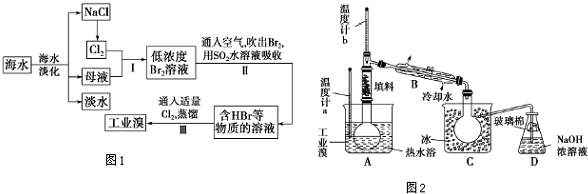
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com