
【题目】华法林是常用的抗凝血药物。下面是利用 Michael 反应合成华法林的一种方法。
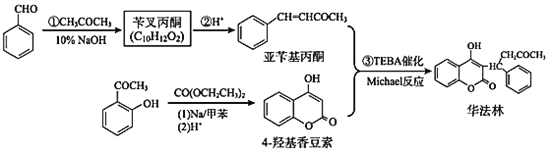
回答下列问题:
(1)![]() 的名称是_____。用银氨溶液检验其官能团的反应的化学方程式为________。
的名称是_____。用银氨溶液检验其官能团的反应的化学方程式为________。
(2)反应①~③中,属于加成反应的是_______(填序号)。
(3)苄叉丙酮的结构简式为 ______。
(4)![]() 中官能团的名称为_______、_______。
中官能团的名称为_______、_______。
(5)反应①除生成苄叉丙酮外,可能生成另一种化合物。该化合具有以下特征:
a.化学式为 C17H18O3;b.核磁共振氢谱有 6 组峰,且面积之比为 1:1:1:2:2:2;
则该化合物的结构简式为_________。
(6) 有多种同分异构体,属于芳香族化合物且为酯的同分异构体数目为 _______,其中不含“-CH3”的结构简式为 _______。
有多种同分异构体,属于芳香族化合物且为酯的同分异构体数目为 _______,其中不含“-CH3”的结构简式为 _______。
【答案】苯甲醛 ![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +3NH3+H2O+2Ag ①③
+3NH3+H2O+2Ag ①③ ![]() 碳碳双键 羰基
碳碳双键 羰基 ![]() 6
6 ![]()
【解析】
(1) ![]() 的名称为苯甲醛,含有醛基的物质与银氨溶液可发生银镜反应;
的名称为苯甲醛,含有醛基的物质与银氨溶液可发生银镜反应;
(2)含有双键或三键的有机物与其他物质发生反应时,双键或三键中的一个断裂,在不饱和碳原子两端分别接上其他原子的反应称为加成反应,根据图示反应过程判断;
(3)苯甲醛(C7H6O)与丙酮(C3H6O)生成苄叉丙酮,化学式为C10H12O2,结合亚苄基丙酮的结构简式和反应②的条件分析判断;
(4)![]() 含有碳碳双键、羰基;
含有碳碳双键、羰基;
(5)苯甲醛(C7H6O)与丙酮(C3H6O)反应生成物的化学式为C17H18O3,核磁共振氢谱有6组峰,且面积之比为1:1:1:2:2:2,即H原子分别为2、2、2、4、4、4,据此分析有机物结构;
(6)属于芳香族化合物且为酯的有机物结构简式中含有苯环和酯基,据此书写同分异构体。
(1)![]() 的名称为苯甲醛;与银氨溶液反应的化学方程式为
的名称为苯甲醛;与银氨溶液反应的化学方程式为![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +3NH3+H2O+2Ag;
+3NH3+H2O+2Ag;
(2)含有双键或三键的有机物与其他物质发生反应时,双键或三键中的一个断裂,在不饱和碳原子两端分别接上其他原子的反应称为加成反应,根据图示反应过程反应①~③中,属于加成反应的是①③;
(3)苯甲醛(C7H6O)与丙酮(C3H6O)生成苄叉丙酮,化学式为C10H12O2,结合亚苄基丙酮的结构简式和反应②的条件,可推测是丙酮中-CH3与苯甲醛中-CHO发生加成反应可得苄叉丙酮的结构简式为![]() ;
;
(4)![]() 中官能团名称为碳碳双键、羰基;
中官能团名称为碳碳双键、羰基;
(5)苯甲醛(C7H6O)与丙酮(C3H6O)反应生成物的化学式为C17H18O3,核磁共振氢谱有6组峰,且面积之比为1:1:1:2:2:2,即H原子分别为2、2、2、4、4、4,推测-分子丙酮中两个-CH3分别与苯甲醛发生加成反应。故该化合物的结构简式为![]() ;
;
(6)![]() 属于芳香族化合物且为酯的有机物结构简式中含有苯环和酯基,同分异构体有:
属于芳香族化合物且为酯的有机物结构简式中含有苯环和酯基,同分异构体有:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 共6种,其中不含-CH3的是
共6种,其中不含-CH3的是![]() 。
。


科目:高中化学 来源: 题型:
【题目】MgSO4·7H2O是一种重要的化工原料,某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2)制取MgSO4·7H2O的实验流程如下:
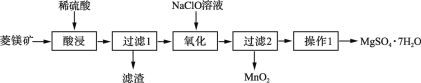
(1)过滤1的滤渣主要成分是____。
(2)氧化时发生反应的离子反应方程式为________________。
(3)操作1要经过____、____、过滤、洗涤、干燥等步骤才可得到产品。
(4)某MgSO4·7H2O产品中混有少量CaSO4、Al2(SO4)3、Fe2(SO4)3,可通过下列方法测定其纯度:
Ⅰ.称取待测样品10.00 g,加水溶解配成 250 mL溶液A待用。
Ⅱ.取10 .00 mL溶液A,加入三乙醇胺溶液,加入少许氨水调节pH至7~8,再用0.02 mol·L-1 EDTA(H2Y2-)与之充分反应,共用去EDTA溶液84.00 mL。
Ⅲ.取25.00 mL溶液A,加入三乙醇胺溶液,再加入0.125 mol·L-1 NaOH溶液调节pH至12~13,用0.02 mol·L-1 EDTA与之充分反应,共用去EDTA溶液10.00 mL。
已知:
① Mg2+在pH=9.1时开始沉淀,pH=12.1时沉淀完全;Ca2+在pH=13.1时还未沉淀。
② Mg2++H2Y2-=MgH2Y、Ca2++H2Y2-=CaH2Y。
③ 在三乙醇胺的作用下其他杂质不与EDTA反应。
计算样品中MgSO4·7H2O的质量分数__________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与NO2+互为等电子体的分子________,根据等电子体原理,在NO2+中氮原子轨道杂化类型是________;O22+与N2互为等电子体,1mol O22+中含有的π键数目为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对装置的描述中正确的是
A.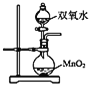 实验室中可用甲装置制取少量 O2
实验室中可用甲装置制取少量 O2
B.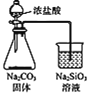 可用乙装置比较C、Si 的非金属性
可用乙装置比较C、Si 的非金属性
C.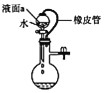 若丙装置气密性良好,则液面a保持稳定
若丙装置气密性良好,则液面a保持稳定
D.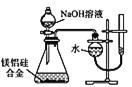 可用丁装置测定镁铝硅合金中 Mg 的含量
可用丁装置测定镁铝硅合金中 Mg 的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高效清洁的火箭燃料,0.5 mol气态肼完全燃烧生成氮气和水蒸气时,放出267 kJ的热量,下列热化学方程式书写正确的是( )
A.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=+534 kJ/mol
B.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=-267 kJ/mol
N2(g)+H2O(g) ΔH=-267 kJ/mol
C.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=-534 kJ/mol
D.N2H4(g)+O2(g)= N2(g)+2H2O(l) ΔH=-534 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
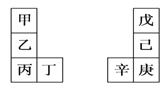
A.丙与庚的原子序数相差3
B.气态氢化物的热稳定性:戊>己>庚
C.乙所在周期元素中,其简单离子的半径最大
D.乙的单质在空气中燃烧生成的化合物只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置不能完成相应实验的是
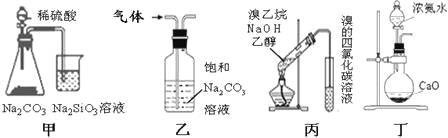
A.甲装置可比较硫、碳、硅三种元素的非金属性强弱
B.乙装置可除去CO2中少量的SO2杂质
C.丙装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯
D.丁装置可用于实验室制备氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(![]() )、肼(
)、肼(![]() )和四氧化二氧(
)和四氧化二氧(![]() )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知:![]()
![]()
![]()
![]()
![]()
![]()
![]() 和
和![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式(![]() 用含
用含![]() 、
、![]() 、
、![]() 的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
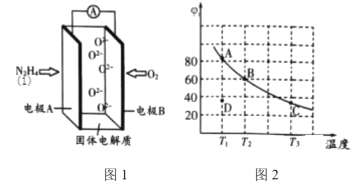
(2)肼(![]() )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(![]() )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________点。![]() 时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的
时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的![]() 平均反应速率为________。
平均反应速率为________。
③若其条件不变,在![]() 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量![]() ,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. 电离常数:Ka(HB)>Ka(HA)
B. Ka(HA)的数量级为10-5
C. 当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D. 等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com