
| A. | 同一主族元素,原子半径越大,其单质的熔点不一定越高 | |
| B. | 全部由非金属元素组成的化合物中一定只有共价键 | |
| C. | 在由锌片、铜片、稀硫酸组成的原电池中,电子由铜片经外电路流向锌片 | |
| D. | 氯化钠和氯化氢分别溶解在水中所克服的粒子间相互作用属于同种类型 |
分析 A.碱金属中原子半径越大,熔点越低,而卤素单质中原子半径越大,熔点越高;
B.铵盐中均为非金属元素;
C.Zn为负极,电子由负极流向正极;
D.氯化钠含离子键,氯化氢含共价键.
解答 解:A.碱金属中原子半径越大,熔点越低,而卤素单质中原子半径越大,熔点越高,则同一主族的元素,原子半径越大其单质的熔点不一定高,故A正确;
B.铵盐中均为非金属元素,为离子化合物,则全部由非金属元素形成的化合物可能是离子化合物,故B错误;
C.在由锌片、铜片、稀硫酸组成的原电池中,Zn为负极,则电子由锌片经外电路流向铜片,故C错误;
D.氯化钠和氯化氢分别溶解在水中所克服的粒子间相互作用分别为离子键、共价键,作用力不同,故D错误;
故选A.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素在周期表中的位置、性质即可解答,注意利用特例分析选项B,题目难度不大,注重基础知识的考查.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaBr、NaI、NaCl | C. | NaBr、NaI | D. | NaCl、I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
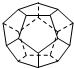 德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如图).请回答:C20分子共有12个正五边形,共有30条棱边,C20晶体属于分子晶体 (填晶体类型).
德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如图).请回答:C20分子共有12个正五边形,共有30条棱边,C20晶体属于分子晶体 (填晶体类型).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| X | 常见的金属,在周期表中的周期序数与族序数相等 |
| Y | 气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z | 其原子质量数为56,中子数为30的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 氮化铝中N的化合价为-3价 | |
| C. | 因为具有抗冲击、导热性好等优良性能,所以氮化铝属于金属材料 | |
| D. | 合成氮化铝的反应符合“绿色化学”的思想 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族元素的原子次外层电子数可能为2或8,不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物两两之间能反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$ +R3COOH
+R3COOH $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CH3COOH
+CH3COOH

 ;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化.
;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
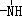 、
、 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com