
【题目】已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,下列说法中正确的是
2NH3(g)△H=-92kJ/mol,下列说法中正确的是
A. 当1molN2与3molH2充分反应,可放出92kJ热量
B. 恒容恒温发生该反应时,向容器中充入少量He,反应速率加快且平衡正向移动
C. 恒压恒温发生该反应时,向容器中充入少量He,反应速率不变且平衡不移动
D. 升高温度时,正、逆反应速率都加快,而逆反应速率增加更多
【答案】D
【解析】
A、该反应是可逆反应,反应物不能完全转化为生成物,所以当1molN2与3molH2充分反应,放出热量小于92kJ,故A错误;
B、恒容恒温发生该反应时,向容器中充入少量He,参加反应的气体分压不变,所以反应速率不变,平衡不移动,故B错误;
C、恒压恒温发生该反应时,向容器中充入少量He,总体积增加,参加反应的气体分压减小,反应速率减小且平衡逆向移动,故C错误;
D、由反应N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol可知,该反应为放热反应,升高温度时,正、逆反应速率都加快,逆反应速率增加更多,平衡向逆反应方向移动,故D正确;
2NH3(g)△H=-92kJ/mol可知,该反应为放热反应,升高温度时,正、逆反应速率都加快,逆反应速率增加更多,平衡向逆反应方向移动,故D正确;
综上所述,本题应选D。


科目:高中化学 来源: 题型:
【题目】一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是( )
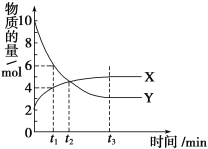
A. 反应的化学方程式为3X(g)![]() 7Y(g)
7Y(g)
B. t1时,Y的浓度是X浓度的1.5倍
C. t2时,正、逆反应速率相等
D. 0到t1时间段内,Y的平均反应速率为4/t1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道:“染色”馒头中添加柠檬黄铬酸铅(PbCrO4)会使人体致癌,已被明文禁用。已知铬元素(Cr)化合价为+6价,则铅元素(Pb)的化合价为( )
A.+1B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的六份溶液:①0.01molL﹣1 CH3COOH溶液;②0.01molL﹣1 HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01molL﹣1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01molL﹣1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液.
(1)其中水的电离程度最大的是__________(填序号,下同),水的电离程度相同的是_____________________.
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②_____③(填“>”“<”或“=“).
(3)将六份溶液同等稀释10倍后,溶液的pH:①_____②,③_____④,⑤_____⑥(填“>”“<”或“=“).
(4)将①④混合,若有c(CH3COO﹣)>c(H+),则混合溶液可能呈___________(填序号).
A.酸性 B.碱性 C.中性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某年春节联欢晚会上,有一幅向观众拜年的对联是:“金银铜铁铬镍铅锌”。针对此联,下列说法正确的是( )
A.它们都属于金属B.它们都是绝缘体
C.它们都能与稀盐酸反应产生氢气D.只用磁铁就能把它们鉴别出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为  ,取Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、NaHCO3三种物质的物质的量为
,取Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、NaHCO3三种物质的物质的量为
A. 2:2 :1 B. 1:1:1 C. 3:2:1 D. 3:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池一直是化学工作者研究的热点之一。
Ⅰ.早期的锌汞纽扣式电池,以锌和氧化汞为电极材料,氢氧化钾溶液为电解液的原电池,有效的解决电池使用寿命短、易发生漏液等问题。
电池总反应为:Zn+HgO = ZnO+Hg。
(1)该电池的正极反应式是___________。
(2)但是该工厂的污水中会含有一定量的+2价的汞离子,通常采用向污水中通入一定量的硫化氢,反应的离子方程式为___________。
(3)该方法的缺点是产物的颗粒比较小,大部分悬浮于污水中,通常采用投入一定量的明矾晶体进行后续处理,请解释其原因___________。
II.锂离子电池由于轻便、比能量大等优点,成为当今社会最为常见的电池。其中的重要材料磷酸亚铁锂(LiFePO4)通常按照下列流程进行生产:
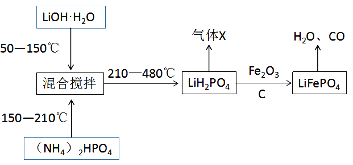
请回答下列问题:
(4)生产过程中“混合搅拌”的目的是__________。气体X除了水蒸气之外,还含有___________(填写化学式)。
(5)请写出一定条件下由LiH2PO4生成LiFePO4的化学方程式__________,当生成1mol磷酸亚铁锂时,转移的电子数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据我国目前汽车业发展速度,预计![]() 年汽车保有量超过
年汽车保有量超过![]() 亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。
亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。
(1)目前,汽车厂商常利用催化技术将尾气中的![]() 和
和![]() 转化成
转化成![]() 和
和![]() ,化学方程式为:_______________;
,化学方程式为:_______________;
为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究:
(资料查阅)①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(2)完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T / ℃ |
|
| 同种催化剂的比表面积
|
| 为以下实验作参照 |
|
|
|
|
| ①___________ | 280 |
|
|
|
| 探究温度对尾气转化速率的影响 |
| ②_________ |
|
|
(图象分析与结论)利用气体传感器测定了三组实验中![]() 浓度随时间变化的曲线图,如图:
浓度随时间变化的曲线图,如图:
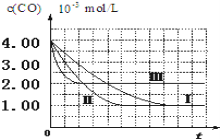
(3)计算第![]() 组实验中,达平衡时
组实验中,达平衡时![]() 的浓度为________;
的浓度为________;
(4)由曲线![]() 、
、![]() 可知,增大催化剂比表面积,汽车尾气转化速率____________________(填“增大”、“减小”、“无影响”)。
可知,增大催化剂比表面积,汽车尾气转化速率____________________(填“增大”、“减小”、“无影响”)。
(5)下列措施中,能减少或控制汽车尾气污染有效且可行的是________.
A.制定严格的汽车尾气排放标准,并严格执行
B.开发清洁能源汽车,如氢能汽车、太阳能汽车等
C.将污染源移到人口密集度低的郊区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.013×105 Pa下,测得的某些烷烃的沸点见下表。据表分析,下列说法正确的是( )
物质名称 | 沸点/℃ |
正丁烷CH3(CH2)2CH3 | -0.5 |
正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷 | 27.8 |
新戊烷 | 9.5 |
正己烷CH3(CH2)4CH3 | 69.0 |
A. 在标准状况时,新戊烷是气体
B. 在1.013×105 Pa、20 ℃时,C5H12都是液体
C. 烷烃随碳原子数增加,沸点降低
D. C5H12随支链增加,沸点降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com