
【题目】下列各组中两个反应所属反应类型相同的是( )
A. 甲烷和氯气在光照下反应;乙烯能使溴水褪色
B. 乙烷在氧气中燃烧;由乙烯制取聚乙烯
C. 乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色
D. 乙烯和水反应制乙醇;乙烯能使溴水褪色
科目:高中化学 来源: 题型:
【题目】氯化亚铜是用途广泛的铜盐产品。CuCl晶体呈白色,微溶于水,不溶于乙醇和稀盐酸,溶于浓盐酸,见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl晶体,设计如下制备流程:

实验涉及的操作及装置如下:

已知
①在较浓的盐酸溶液中:
a.Cu2+主要以[CuCl4]2-(呈黄色)形式存在
b.Fe3+能溶解于萃取剂一甲基异丁基甲酮(无色透明液体,密度为0.8g/cm3)
②CuCl在溶液中存在络合与解离平衡:CuCl(s)+3Cl-(aq)![]() [CuCl4]3-(aq无色)
[CuCl4]3-(aq无色)
③SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成SO2和HCl气体
请回答:
(1)下列有关CuCl2提纯操作正确的是______
A.将氧化液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞,用力振摇(见上图1)
B.经几次振摇并打开上口玻璃塞放气后,将分液漏斗置于铁架台的铁圈上,静置片刻
C.Fe2+经氧化、萃取、分液,进入有机相除去
D.取分液后的水相少许,滴入KSCN溶液检验萃取是否完全
(2)还原反应装置如上图2所示:
①向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞_____(填“a”、“b”或“a和b”)。
②水相中[CuCl4]2-被SOCl2还原为[CuCl4]3-的离子方程式为______。
③判断反应完成的实验现象是________________。
(3)向混合液中加入大量去氧水能得到CuC1悬浊液的原因是___________
(4)“系列操作”包括:抽滤→洗涤→干燥。下列说法不正确的是__________
A.抽滤操作用到的器材包括滤纸、布氏漏斗、吸滤瓶、安全瓶和抽气泵等
B.可选用无水乙醇洗涤CuCl,洗涤时应关闭水龙头,使洗涤剂缓慢通过沉淀物
C.取最后一次洗涤液,滴加BaCl2溶液,若无白色沉淀产生,则证明产品已洗净
D.在避光下产品应置于A处真空干燥(上图3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5 (g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。 根据上图回答下列问题:

(l) PCl5分解成PC13和Cl2的热化学方程式是___________上述分解反应是一个可逆反应。温度T1时,在密闭容器中加人0.80 mol PCl5,反应达平衡时PCls还剩0.60 mol,其分解率a1等于____;若反应温度由T1升高到T2,平衡时PCls的分解率为a2,a2 ___a1(填“大于”、“小于”或“等于”);
(2)工业上制备PCl5通常分两步进行,先将P和CL2反应生成中间产物PC13,然后降温,再和Cl2反应生成PCl3原因是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷是一种有效、安全的固体储氢材料.氨硼烷的结构和乙烷相似,如图.
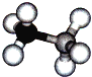
(1)氨硼烷的晶体类型为__.
(2)氮和硼比较,电负性大的元素为__(填元素符号).
(3)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为__和__.
(4)氨硼烷__(填“能”或“不能”)溶于水,其原因是__.
(5)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g.
该配合物中镍离子的基态电子排布式为__.该配合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 碱性氧化物、金属氧化物、氧化物
C. 胶体、分散系、混合物
D. 复分解反应、置换反应、化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。

(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)____(填“增大”、“减小”或“不变”,下同),转化率α(C3H8)_____。
②温度升高,副反应更容易发生的主要原因是__________________________________。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分
别为104 Pa和105 Pa)。

①104 Pa时,图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=_____(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。
该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
①图中催化剂为______。
②298 K 时,该工艺总反应的热化学方程式为_____________________________________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。
(1)在现代化学中,常利用________上的特征谱线来鉴定元素,称为光谱分析。
(2)基态N原子的价电子占据的能量最高的能级是________,价电子在该能级上的排布遵循的原则是_____________。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。lmolNH4BF4含有______mol配位键。
(4)化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。N4比P4的沸点________,原因为_______________________。

(5)尿素(H2NCONH2)也是一种常用的化肥,其分子中原子的杂化轨道类型有________,σ键和π键数目之比为__________。
(6)Cu3N具有良好的电学和光学性能,其晶胞结构如图。Cu+半径为a pm,N3-半径为b pm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为________,Cu3N的密度为________g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、同温同压下,若A容器中充满O2、B容器中充满O3。
(1)若所含分子总数相等,则A容器和B容器的容积之比是_____。
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是____。
Ⅱ、现有14.4g一氧化碳和二氧化碳的混合气体,在标准状况下其体积为8.96L。
请回答下列问题:
(1)该混合气体的平均摩尔质量为____。
(2)混合气体中碳原子的个数为____(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)。

气球中收集到的气体的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某废催化剂(含ZnO、CuO、Fe2O3、石墨及MnO2等)中回收金属并制取活性氧化锌的工艺流程如下(已知:Zn及其氧化物、氢氧化物的性质与Al及其相应化合物性质类似):

(1)废催化剂“破碎”的目的是____________________________________________。
(2)“氧化”时Mn2+被氧化的离子方程式为_________________________________。
(3)“中和、沉淀”时,若pH过高,则碱式碳酸锌的产率偏小。写出其反应的离子方程式(任写一个即可):____________________________________________。
(4)测得“粗铜粉”中铜的质量分数的实验步骤如下:
I.准确称取粗铜粉mg,加入足量盐酸和H2O2溶液使其完全溶解。
Ⅱ.将溶液煮沸1~2min,除去过量的H2O2。
Ⅲ.滴入铁掩蔽剂排除Fe3+的干扰。然后加入稍过量的KI溶液(反应:2Cu2++4I-=2CuI↓+I2),再加入几滴淀粉溶液作指示剂,用 c mol ·L-1Na2S2O3标准溶液滴定至蓝色消失(I2+2S2O32-=2I-+S4O62-)且半分钟内不变色,共消耗Na2S2O3标准溶液VmL。
①铜的质量分数为______________________。
②缺少步骤Ⅱ哙会使测得的铜的质量分数___________(填“偏大”、“偏小”、或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com