
| A. | 80g | B. | 160g | C. | 98g | D. | 无法确定 |
分析 Cu(OH)2和CuO均与稀盐酸反应生成CuCl2,根据Cu、Cl原子守恒得出n(Cu)=n(CuCl2)=$\frac{1}{2}$n(HCl),Cu(OH)2和CuO的混合物用酒精灯加热,只有氢氧化铜分解生成CuO和水,所以最终得到的固体是CuO,根据Cu原子守恒计算最终CuO的物质的量,根据m=nM计算所得固体质量.
解答 解:Cu(OH)2和CuO均与稀盐酸反应生成CuCl2,根据Cu、Cl原子守恒得出混合物中铜元素n(Cu)=n(CuCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×1mol/L×2L=1mol,Cu(OH)2和CuO的混合物用酒精灯加热,只有氢氧化铜分解生成CuO和水,所以最终得到的固体是CuO,根据Cu原子守恒计算最终n(CuO)=n(Cu)=1mol,m(CuO)=nM=1mol×80g/mol=80g,故选A.
点评 本题考查混合物的计算,为高频考点,明确各个物理量关系式是解本题关键,注意原子守恒的灵活运用,明确最终物质成分,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | ||
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙>丁>戊 | |
| B. | 最高化合价:甲<丁<戊 | |
| C. | 最高价氧化物的水化物的酸性:丙<甲<乙 | |
| D. | 非金属性:乙>丁>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
| A. | 偏高 | B. | 偏低 | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
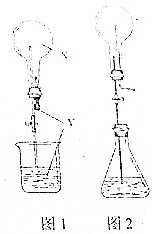 关于喷泉实验,回答下列问题:
关于喷泉实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将0.2mol•L-1氨水与0.2mol•L-1盐酸混合,c(NH3•H20)+c(NH4+)=c(Cl-) | |
| B. | 常温下NH4A溶液中的pH=6,则c(A-)-c(NH4+)=9.9×10-7mol•L-1 | |
| C. | c(NH4+)相等的NH4Cl,NH4HCO3溶液中,溶质初始浓度:c(NH4Cl)=c(NH4HCO3) | |
| D. | 将0.2molCO2缓慢通入含有0.3molNAOH的溶液中,c(CO32-)>c(HCO3-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
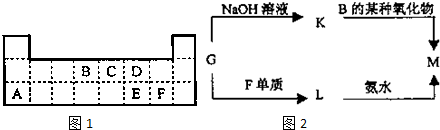
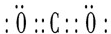 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com