
分析 加混合物19.0g混合粉末放入过量的盐酸中,得到4.48LCO2(标准状况下)物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,根据质量守恒和碳守恒列方程组进行分析解答.
解答 解:设碳酸钠和碳酸氢钠的物质的量分别为xmol和ymol,根据质量守恒分析106x+84y=19.0g,根据碳守恒分析可知:x+y=0.2mol,解之得x=0.1mol,y=0.1mol,所以该混合物中碳酸钠的质量分数为:$\frac{0.1×106}{19}×100%$=55.8%,混合物中碳酸钠和碳酸氢钠的物质的量之比0.1:0.1=1:1,
答:(1)该混合物中碳酸钠的质量分数55.8%;
(2)该混合物中碳酸钠和碳酸氢钠的物质的量之比为1:1.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量的关系为解答的关键,注意守恒法在计算中的应用,侧重分析与计算能力的考查,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2+、H+、Cl-、NO3- | B. | Na+、Ba2+、OH-、NO3- | ||
| C. | OH-、K+、NO3-、HCO3- | D. | Fe3+、NH4+、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler试剂(K2HgI4的KOH溶液)可与NH4+反应生成沉淀
实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler试剂(K2HgI4的KOH溶液)可与NH4+反应生成沉淀查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量CH3COONH4固体 | B. | 加浓醋酸 | ||
| C. | 加少量NaCl固体 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
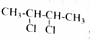 为原料制备某五元环化合物的流程如图所示:
为原料制备某五元环化合物的流程如图所示: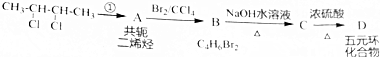
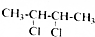 的系统命名为2,3-二氯丁烷.
的系统命名为2,3-二氯丁烷.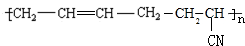 等.
等.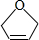 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 则下列预测正确的是( )
则下列预测正确的是( )| A. | 该单质很难与其他物质发生反应 | B. | 其最高价氧化物的化学式为XO3 | ||
| C. | 第三层的电子数为8个 | D. | 元素X是一种非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com