
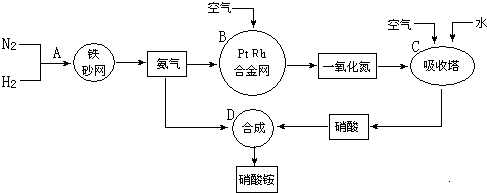
分析 合成氨的工业设备是合成塔;合成氨的反应属于放热反应;N2与H2合成NH3所用的催化剂是铁砂网,氨气和空气进入氧化装置,在催化剂作用下催化氧化生成一氧化氮,生产中应防止催化剂中毒,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸,硝酸和氨气反应生成硝酸铵,
(1)在上述工业制硝酸的生产中,B是氨气的催化氧化,氨气和氧气反应生成一氧化氮和水,B设备的名称为氧化炉;
(2)N2与H2合成NH3所用的催化剂是铁触媒,设置热交换器的目的是利用利用反应放出的热量;在合成硝酸的吸收塔中通入空气的目的是NO全部转化为硝酸;
(3)依据化学方程式分析氨气化合价变化,判断发生氧化反应的物质是氨气,原电池中在负极失电子生成氮气,正极上氧气得到电子生成氢氧根离子;
(4)根据氮原子守恒可知,NH3~NO~HNO3,以此计算;
(5)铵态氮肥水解显酸性与碱性物质混合后能反应.
解答 解:(1)在上述工业制硝酸的生产中,B是氨气的催化氧化,氨气和氧气反应生成一氧化氮和水,B设备的名称为氧化炉,反应中氨气被氧化生成NO,在反应中的氧化产物是NO,
故答案为:氧化炉;NO;
(2)此生产过程中,N2与H2合成NH3所用的催化剂是铁触媒,在合成氨的设备(合成塔)中,设置热交换器的目的是利用余热,节约能源,在合成硝酸的吸收塔中通入空气的目的是可使NO全部转化成HNO3 ,
故答案为:铁触媒; 利用余热,节约能源; 可使NO全部转化成HNO3 ;
(3)电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+3O2--6e-=N2+3H2O,
故答案为:2NH3+3O2--6e-=N2+3H2O;
(4)由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8366mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为:$\frac{1mol}{1mol+0.8832}$×100%=53%,即制HNO3所用去的NH3的质量占总耗NH3质量的53%,
故答案为:53;
(5)硝酸铵是一种常用的氮肥,在使用该化肥时避免与碱性肥料一起使用,理由是:NH4+水解呈酸性,与碱混合促进其水解,肥效损失,
故答案为:NH4+水解呈酸性,与碱混合促进其水解.
点评 本题考查了工业合成氨、工业生产硝酸的流程、设备名称、反应催化剂选择、原电池电极反应、化学方程式定量计算等知识点,掌握基础是解题关键,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应混合物的浓度改变 | B. | 反应混合物的压强改变 | ||
| C. | 正、逆反应速率改变 | D. | 反应物的转化率改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 大量排放SO2或CO2都会导致酸雨的形成 | |
| C. | 采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 利用清洁能源如太阳能、潮汐能、风能来发电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 除去粗盐中的Mg2+应加入过量的KOH,然后过滤 | |
| D. | 粗盐提纯最后一步应向滤液中加入盐酸,调节溶液的值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+,K+,MnO4-,Cl- | B. | Na+,H+,NO3-,SO42- | ||
| C. | K+,Ca2+,NO3-,CO32- | D. | Cu2+,Na+,Cl-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com