
 Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)
Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒) 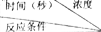 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 260 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
分析 Ⅰ(1)从反应条件可知考虑了哪些条件影响反应速率,从给出现象可知外界条件对反应速率的具体影响;
(2)对比不同条件,反应所需时间的多少,可知浓度、温度、催化剂对反应速率的影响;
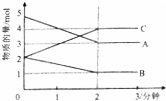
Ⅱ(3)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(4)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;
(5)可逆反应达到平衡状态时,正逆反应速率相等,各组分浓度不再变化,若存在有色物质,则有色物质的颜色也不再变化,据此对各选项进行判断.
解答 解:Ⅰ(1)从表中数据看,浓度相同时,无催化剂不加热,几乎不反应,而无催化剂加热,需要360秒,说明升高温度,反应速率加快;使用催化剂加热,需要10秒,说明使用催化剂能大大提高反应速率,该研究小组在设计方案时,考虑了浓度、催化剂、温度等因素对过氧化氢分解速率的影响,
故答案为:催化剂,温度;
(2)对比不同条件,反应所需时间的多少,可知浓度、温度、催化剂对反应速率的影响,
故答案为:一般加入催化剂、反应速率加快(或,升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢);
Ⅱ(3)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B?2C,
故答案为:2A+B?2C;
(4)由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为:v=$\frac{△c}{△t}$=$\frac{1mol}{5L}$÷2min=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
(5)a.v(A)=2v(B)不能说明正反应和逆反应的关系,故无法判断反应是否达到平衡,故a错误;
b.容器内各物质的物质的量相等,不能说明各组分的浓度不再变化,无法判断是否达到平衡状态,故b错误;
c.在该反应中A和C的计量数相等,当v逆(A)=v正(C)时,正逆反应速率相等,说明反应已达平衡状态了,故c正确;
d.只有A为有色物质,当容器内气体的颜色保持不变,说明各组分的浓度不再变化,该反应已经达到平衡状态,故d正确;
故答案为:cd.
点评 本题通过图表数据,考察了外界条件对反应速率的影响,要注意分析其他条件相同,只有一个条件改变时,如何影响反应速率;化学平衡图象的计算要注意把握由图象判断化学方程式的方法以及反应现象与结论的推断,试题侧重考查学生的分析能力及化学计算、化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
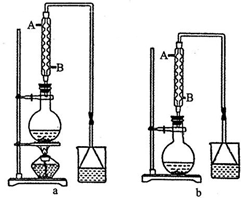 实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{135}$I位于元素周期表中第4周期ⅦA族 | |
| B. | ⅦA族氢化物的沸点:HF<HCl<HBr<HI | |
| C. | ${\;}_{53}^{135}$I核内的中子数与核外电子数之差为29 | |
| D. | ${\;}_{53}^{135}$I2和${\;}_{53}^{131}$I2是碘的两种同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>X>W | |
| B. | 简单氢化物的稳定性:X>Z>W | |
| C. | 最高价氧化物的水化物的酸性:W>Z | |
| D. | X可分别与W、Y形成化合物,其所含的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | 铝片与浓硫酸的反应 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
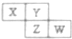 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氧化物比Y的稳定 | |
| B. | X与Y形成的化合物都易溶于水 | |
| C. | Z与Y只能形成ZY3型化合物 | |
| D. | W的最高价氧化物对应水化物的酸性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
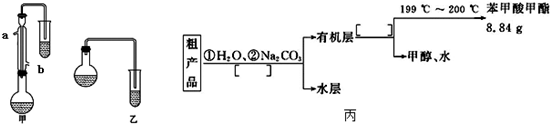
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
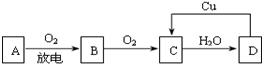
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com