
 硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.分析 (1)由Cu原子、硝酸根离子守恒可知n(HNO3)=2n[Cu(NO3)2]=2n(Cu),再根据c=$\frac{n}{V}$计算硝酸浓度;
根据c=$\frac{1000ρω}{M}$计算浓硝酸的物质的量浓度,再根据V=$\frac{n}{c}$计算需要浓硫酸体积;
(2)发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据差量法计算溶液质量增重;根据电子转移守恒计算生成NO的物质的量,将NO通入NaOH溶液,同时通入氧气,气体被完全吸收,发生反应NO+NO2+2NaOH=2NaNO2+H2O时需要氧气最少,计算NO2的物质的量,结合2NO+O2=2NO2计算需要通入氧气;
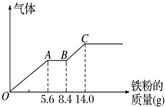
(3)由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为Fe+2H+=Fe2++H2↑.
根据OA段离子方程式计算原混合酸中NO3-物质的量,与混合溶液中硝酸为每一份中的2倍;
最终消耗Fe为14g,此时溶液中溶质为 FeSO4,则n( FeSO4)=n(Fe),由硫酸根守恒n(H2SO4)=n( FeSO4),再根据c=$\frac{n}{V}$计算c(H2SO4).
解答 解:(1)由Cu原子、硝酸根离子守恒可知n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2×$\frac{ag}{64g/mol}$=$\frac{a}{32}$mol,则硝酸浓度为$\frac{\frac{a}{32}mol}{V×1{0}^{-3}L}$=$\frac{125a}{4V}$mol/L;
根据c=$\frac{1000ρω}{M}$可知,浓硝酸的物质的量浓度为$\frac{1000×ρ×w%}{63}$mol/L=$\frac{10ρw}{63}$mol/L,需要浓硝酸的体积为$\frac{\frac{a}{32}mol}{\frac{10ρw}{63}mol/L}$=$\frac{63a}{320ρw}$L=$\frac{1575a}{8ρw}$mL,
故答案为:$\frac{125a}{4V}$;$\frac{1575a}{8ρw}$;
(2)设溶液质量增重为m,则:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 溶液质量增重
192 192-60=132
bg m
所以m=$\frac{132b}{192}$g=$\frac{11b}{16}$g,
Cu的物质的量为$\frac{bg}{64g/mol}$=$\frac{b}{64}$mol,根据电子转移守恒,生成NO物质的量为$\frac{\frac{b}{64}mol×2}{3}$=$\frac{b}{96}$mol,将NO通入NaOH溶液,同时通入氧气,气体被完全吸收,发生反应NO+NO2+2NaOH=2NaNO2+H2O时需要氧气最少,则NO2的物质的量为$\frac{b}{96}$mol×$\frac{1}{2}$=$\frac{b}{192}$mol,由2NO+O2=2NO2可知,需要通入氧气为$\frac{b}{192}$mol×$\frac{1}{2}$×22.4L/mol=$\frac{7b}{120}$L,
故答案为:$\frac{11b}{16}$;$\frac{7b}{120}$;
(3)由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为Fe+2H+=Fe2++H2↑.
OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,OA段消耗Fe为5.6g,所以n(NO3-)=n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,原混合物中硝酸物质的量为0.1mol×2=0.2mol;
最终消耗Fe为14g,此时溶液中溶质为 FeSO4,则n( FeSO4)=n(Fe)=$\frac{14g}{56g/mol}$=0.25mol,由硫酸根守恒n(H2SO4)=n( FeSO4)=0.25mol,则c(H2SO4)=$\frac{0.25mol}{0.1L}$=2.5mol/L,
答:原混合酸中硝酸的物质的量是0.2mol,硫酸的浓度为2.5mol/L.
点评 本题考查化学计算,涉及字母型计算,为易错题目,(2)中计算需要氧气体积为难点,中学基本不涉及该反应,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 电解质:水溶液是否导电 | |
| B. | 原子晶体:构成晶体的微粒是否是原子 | |
| C. | 共价分子:分子中原子间是否全部是共价键 | |
| D. | 化学平衡状态:平衡体系中各组分的物质的量浓度是否相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
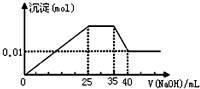 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )| A. | 原溶液一定不存在H+、Cu2+、CO32- | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH溶液浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 软脂酸(C15H31COOH) | B. | 油酸(C17H33COOH) | ||
| C. | 草酸(HOOC-COOH) | D. | 氨基酸(H2N-CH2COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先通过足量澄清石灰水,再通过足量品红溶液 | |
| B. | 先通过足量饱和NaHCO3溶液,再通过澄清石灰水 | |
| C. | 先通过足量NaOH溶液,再通过澄清石灰水 | |
| D. | 先通过足量酸性KMnO4溶液,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水、高锰酸钾溶液褪色 | |
| B. | 碘片、氯化铵晶体受热消失 | |
| C. | 二氧化硫和氯气使品红溶液褪色 | |
| D. | 乙醛、葡萄糖与银氨溶液水浴加热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数K1 | 电离常数K2 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
| A. | pH:Na2CO3溶液小于Na2SO3溶液 | |
| B. | 结合H+能力:CO32-弱于SO32- | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | ①与②溶液等体积混合后的溶液中:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com