
| A. | 浓硫酸中硫酸物质的量浓度为18.4 mol/L | |
| B. | 配制溶液所需浓硫酸体积为24mL | |
| C. | 配制溶液时仅需的仪器有容量瓶、烧杯、玻璃棒、量筒 | |
| D. | 配制溶液时,量取硫酸注入到烧杯中,加水稀释,冷却后再转移到容量瓶中 |
分析 A.依据C=$\frac{1000ω}{M}$计算浓硫酸的浓度;
B.需要450mL1mol/L的硫酸,应选择500mL容量瓶,实际配制500mL溶液,依据稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
C.依据用浓溶液配制一定物质的量浓度溶液需要仪器解答;
D.依据浓硫酸稀释的正确操作解答.
解答 解:A.密度为1.84g/cm3,溶质的质量分数98%的浓硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,故A正确;
B.需要450mL1mol/L的硫酸,应选择500mL容量瓶,实际配制500mL溶液,依据稀释过程中溶质的物质的量不变得18.4mol/L×V=500mL×1mol/L,解得V=27.2mL,故B 错误;
C.用浓溶液配制一定物质的量浓度溶液需要仪器:量筒、胶头滴管、烧杯、玻璃棒、容量瓶,缺少胶头滴管,故C错误;
D.浓硫酸稀释的正确操作:将浓硫酸沿着烧杯壁缓缓注入水中,用玻璃棒不断搅拌,故D错误;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫化钠的水解反应:S2-+H3O+HS-+H2O | |
| D. | 将0.2 mol•L-1的NH4Al(SO4)2溶液与0.3 mol•L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
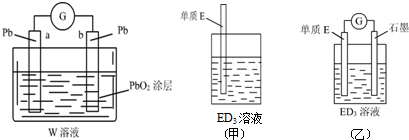
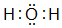 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键是一种作用力 | |
| B. | 氢键也属化学键 | |
| C. | 化学键可以使离子相结合,也可以使原子相结合 | |
| D. | 化学方应过程中,反应物分子内的化学键断裂,生成物中的化学键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
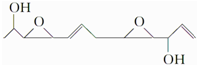 下列关于该化合物的说法正确的是( )
下列关于该化合物的说法正确的是( )| A. | 分子式为C12H19O4 | B. | 是乙醇的同系物 | ||
| C. | 可发生氧化反应 | D. | 处于同一平面的原子最多有5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | KHCO3溶液与Al2(SO4)3溶液混合:3HCO3-+Al3+=Al(OH)3↓+3CO2↑ | |
| C. | 将过量铁粉加入到稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 碳酸电离:H2CO3=H++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使酸性KMnO4褪色:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| B. | Fe(OH)2与HNO3溶液的反应:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 足量NaOH与磷酸二氢铵反应:OH-+NH4+=NH3•H2O | |
| D. | 将SO2通入BaCl2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | 氯水和活性炭使红墨水褪色 | |
| C. | 漂白粉和钠长期暴露在空气中变质 | |
| D. | 氯水和过氧化钠使品红褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com