
【题目】某兴趣小组探究SO2气体还原Fe3+、I2(体系均为酸性条件),它们使用的药品和装置如图所示:

(1)SO2气体还原Fe3+后的所有产物有___________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是______________;
(2)写出装置B中反应的离子方程式________________________;装置C的作用是________________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、然后干燥,在这一系列操作中没有用到的仪器是____________
A、蒸发皿 B、石棉网 C、漏斗 D、玻璃棒 E、坩埚
(4)在上述装置中通入过量的SO2,为了验证SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分为三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去;
方案②:往第二份试液中加入KSCN溶液(硫氰化钾,遇到Fe3+时溶液变成血红色),溶液不变红,再加入某种氧化剂,溶液变红;
方案③:往第三份试液中加入用盐酸酸化的BaCl2溶液,产生白色沉淀。
上述方案不合理的是_______________,原因是___________________________。
【答案】Fe2+、H+、SO42- 1:2 SO2 + I2 + 2H2O =4H+ + 2I- + SO42- 处理尾气,防止污染环境 BE ① 二氧化硫、亚铁离子都使酸性高锰酸钾溶液褪色
【解析】
⑴SO2气体还原Fe3+生成亚铁离子、硫酸根和氢离子,参加反应的SO2变为硫酸根,升高2个价态,Fe3+变为亚铁离子,降低1个价态,因此可得参加反应的SO2和Fe3+的物质的量之比。
⑵装置B中是二氧化硫和单质碘反应生成硫酸和氢碘酸,还有二氧化硫没有反应完,因此装置C的作用是处理尾气,防止污染环境。
⑶蒸发需要蒸发皿和玻璃棒,冷却结晶、过滤时需要玻璃棒和漏斗、然后干燥,在这一系列操作中没有用到的仪器是石棉网和坩埚。
⑷过量的二氧化硫能与高锰酸钾发生氧化还原反应使酸性高锰酸钾溶液褪色,亚铁离子也能使酸性高锰酸钾溶液褪色,因此上述方案不合理的是方案①。
⑴SO2气体还原Fe3+生成亚铁离子、硫酸根和氢离子,因此所有产物有Fe2+、H+、SO42-,参加反应的SO2变为硫酸根,升高2个价态,Fe3+变为亚铁离子,降低1个价态,因此参加反应的SO2和Fe3+的物质的量之比是1:2,故答案为:Fe2+、H+、SO42-;1:2。
⑵装置B中是二氧化硫和单质碘反应生成硫酸和氢碘酸,其反应的离子方程式SO2 + I2 +2H2O =4H+ + 2I- + SO42-;还有二氧化硫没有反应完,因此装置C的作用是处理尾气,防止污染环境,故答案为:SO2 + I2 +2H2O =4H+ + 2I- + SO42-;处理尾气,防止污染环境。
⑶蒸发需要蒸发皿和玻璃棒,冷却结晶、过滤时需要玻璃棒和漏斗、然后干燥,在这一系列操作中没有用到的仪器是BE,故答案为:BE。
⑷过量的二氧化硫能与高锰酸钾发生氧化还原反应使酸性高锰酸钾溶液褪色,亚铁离子也能使酸性高锰酸钾溶液褪色,因此上述方案不合理的是方案①,原因是二氧化硫、亚铁离子都使酸性高锰酸钾溶液褪色,故答案为:①;二氧化硫、亚铁离子都使酸性高锰酸钾溶液褪色。


科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
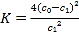
A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3.06 g铝和镁的混合物粉末放入100 mL盐酸中,恰好完全反应,并得到标准状况下3.36 LH2 计算:(要有过程)
(1)该合金中铝的物质的量_____。
(2)反应后溶液中Cl﹣的物质的量浓度(假定反应体积仍为100 mL)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图象正确的是( )
A.25℃时,向亚硫酸溶液中通入氯气
B.向NaAlO2溶液中通入HCl气体
C.向少量氯化铁溶液中加入铁粉
D.向NaOH、Ba(OH)2、NaAlO2的混合液中通入CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向两个容积相同的烧瓶内分别充入一定量的HCl与NH3(假设烧瓶内其它气体难溶于水)。利用如图所示的装置进行实验,实验开始前各活塞均关闭。

(1)同温同压下,两个烧瓶内充入的HCl与NH3分子数目之比为___,烧瓶Ⅱ中喷泉的颜色是___。
(2)单独进行喷泉实验后,烧瓶I中c(Cl-)=___molL-1(实验条件下气体摩尔体积为Vm)
(3)实验表明,若只是关闭b、打开a、c,则易在烧瓶I中观察到白烟,这表明气体分子扩散速率随着气体相对分子质量的增大而____(填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是( )

A. 浓硫酸B. 饱和氯化钠溶液C. 浓氢氧化钠溶液D. 氢氧化钙悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是___。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是_____________________________________。
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式___________________________________。
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL____mol/L____溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起了主要作用。
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,通入SO2,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2(无氧)溶液中通入SO2 |
向烧杯中分别加入25mL0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是______________________________。
(4)图2,BaCl2溶液中发生反应的离子方程式为_________。
(5)依据上述图像你得出的结论是________,说明理由_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法制取纯净水的过程如下图所示。
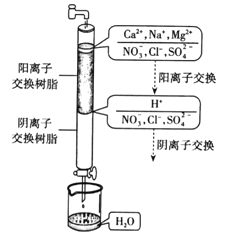
请根据图示回答下列问题:
(1)若水龙头中出来的是硬水,则其中含有较多的___离子。
(2)阳离子交换树脂中所含的大量阳离子是___,根据电荷守恒可知,通过阳离子交换树脂后,水中阳离子的数目___(填“增多”、“减少”或“不变”)。
(3)水中的NO3、Cl、SO42,通过阴离子交换树脂转化为___离子,进而与H+反应生成H2O,有关反应的离子方程式为___。
(4)通过净化处理后,水的导电能力___(填“增强”、“减弱”或“不变”),原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com