
| A. | Cl-、NO3-、Fe3+、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
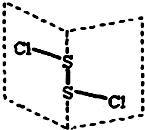 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )| A. | S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2的电子式是:Cl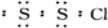 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 6 | C. | 8 | D. | 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠固体中含有碳酸氢钠固体,可用灼烧的方法 | |
| B. | 用酚酞溶液可以鉴别饱和食盐水和饱和纯碱溶液 | |
| C. | 25℃,碳酸氢钠在水中的溶解度比碳酸钠的大 | |
| D. | 氢氧化钠与二氧化碳的反应与量有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
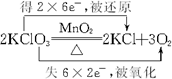 .
.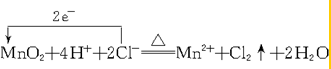 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al(OH )3胶体中加入酒精溶液能发生聚沉现象 | |
| B. | 豆浆和雾都是胶体 | |
| C. | Fe(OH )3 胶体能透过滤纸 | |
| D. | 向沸水中加入饱和的FeCl3溶液,可制备Fe(OH )3 胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
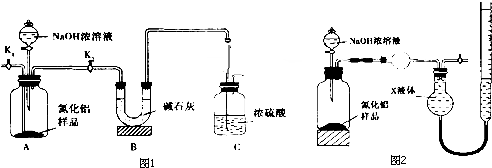

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com