
 4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。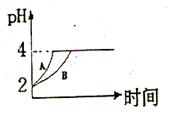
 Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。 4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。 4C (g) △H >0
4C (g) △H >0  Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使c (Cu2+ ) c 2(OH - ) ≥ 2×10 -20 已知c( Cu2+) ="0.02" mol·L-1所以c 2(OH - ) ≥1×10 -18
Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使c (Cu2+ ) c 2(OH - ) ≥ 2×10 -20 已知c( Cu2+) ="0.02" mol·L-1所以c 2(OH - ) ≥1×10 -18 XA+ +Y B-
XA+ +Y B-

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
 cZ(g);△H=Q,有下图所示关系,下列判断中正确是( )
cZ(g);△H=Q,有下图所示关系,下列判断中正确是( )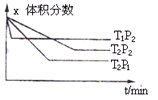
| A.a+b < c, Q > 0 | B.a+b < c, Q < 0 |
| C.a+b > c, Q > 0 | D.a+b > c, Q < 0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是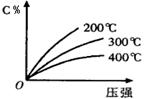
| A.达到平衡后,加入催化剂,C%不变 |
| B.该反应为放热反应 |
| C.化学方程式中m+n>e+f |
| D.达到平衡后,增加A的质量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)△H=一92.6kJ/mol.实验测得起始、平衡时的有关数据如下表: ( )
2NH3(g)△H=一92.6kJ/mol.实验测得起始、平衡时的有关数据如下表: ( )| 容器 | 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(>0) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.其他条件不变时,升高温度,化学反应速率加快 |
| B.其他条件不变时,增大浓度,化学反应速率加快 |
| C.化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 |
| D.化学反应达到反应限度时,正反应的速率与逆反应的速率相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )
2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )| A.67% | B.50% | C.25% | D.缺少条件无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g)已经达到平衡状态的是
2HI(g)已经达到平衡状态的是| A.①③ | B.②⑥ | C.③⑥ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com