
化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
FeCl3+H2S=FeCl2+S;PbO2+4HCl=PbCl2+Cl2↑+2H2O
2Fe(OH)2+Cl2+2KOH=2Fe(OH)3+2KCl;Cl2+2KOH=KCl+KClO+H2O
水溶液中的复分解反应:(Se元素的原子序数为34)
CuSO4+H2S=CuS↓+H2SO4;H2SeO4+2NaN3=Na2SeO4+2HN3;HN3+Na2S=NaN3+H2S
热分解反应:
BaCO3 BaO+CO2↑;MgCO3
BaO+CO2↑;MgCO3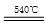 MgO+ CO2↑;CuCO3
MgO+ CO2↑;CuCO3 CuO+ CO2↑
CuO+ CO2↑
下列说法不正确的是
A.氧化性(酸性溶液):PbO2>Fe3+>S
B.还原性(碱性溶液):Fe(OH)2>KCl>Cl2
C.酸性(水溶液):H2S>H2SO4>H2SeO4>HN3
D.热稳定性:CaCO3>FeCO3>Ag2CO3
C
【解析】
试题分析:A.根据物质的氧化性:氧化剂>氧化产物,结合方程式可知:PbO2>Cl2> Fe3+>S,正确。B.还原性:还原剂>还原产物,结合方程式可得Fe(OH)2>KCl>Cl2,正确;C.根据复分解反应的规律:强酸制取弱酸,可得酸溶液的酸性(水溶液):H2SO4>H2SeO4>HN3 >H2S,CuSO4+H2S=CuS↓+H2SO4发生是由于易溶的物质制取难溶性的物质,与酸的酸性强弱无关,错误;D.物质的稳定性越强,分解的温度就越高,根据分解反应的温度可知:热稳定性:CaCO3>FeCO3>Ag2CO3,正确。
考点:考查化学方程式在体现元素及其化合物的性质中的应用的知识。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源:2014-2015湖南省郴州市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列应用化学学科研究物质性质的基本方法或所得结论中,不正确的是
A.根据物质的元素组成,将纯净物分为单质和化合物
B.通过镁、锌、铁分别与稀盐酸反应的实验现象,比较不同金属的活泼性强弱
C.根据铁制品表面的锈可用稀盐酸溶解除去的事实,说明铁锈主要成分是酸性氧化物
D.打开盛装浓盐酸的试剂瓶塞,观察现象,了解盐酸的某些物理性质
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.Na2O2与H2O反应制备O2:Na2O2+H2O =2Na++2OH-+O2↑
B.硅与NaOH溶液的反应:Si+2OH-+H2O=SiO32 -+2H2↑
C.硫酸与Ba(OH)2溶液反应:Ba2++OH-+H++ SO42 -= BaSO4↓+H2O
D.氯气溶于水的反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一12月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.二氧化硅是生产光纤制品的基本原料
B.水玻璃可用于生产黏合剂和防火剂
C.涂油层、通过电镀加上金属层、制成合金等都是保护金属的措施
D.相同条件下,溶液中Cu2+、Zn2+、H+、Na+的氧化性依次减弱
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:实验题
(14分)某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
III.按如图所示装置连接仪器、检查气密性、装入化学试剂。
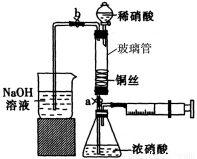
(1)过程I发生反应的离子方程式是 。
(2)写出过程III中检查气密性的方法 。
(3)过程III的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是 ,一段时间后使反应停止的操作是 ,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目是 ,该反应的离子方程式是 。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):
实验编号 | 水温/℃ | 液面上升高度 |
1 | 25 | 超过试管的2/3 |
2 | 50 | 不足试管的2/3 |
3 | 0 | 液面上升超过实验1 |
①根据上表得出的结论是温度越 (填“高”或“低”),进入试管中的溶液越多。
②查阅资料:a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO2 3HNO2 =HNO3+2NO+H2O;
b.HNO2不稳定。
则产生上述现象的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列事实说明HNO2为弱电解质的是
①0.1 mol/L HNO2溶液的pH=2.1; ②常温下NaNO2溶液的pH>7 ; ③用HNO2溶液做导电实验时,灯泡很暗;④HNO2溶液和KCl溶液不发生反应 ⑤HNO2能与碳酸钠反应制CO2;⑥HNO2不稳定,易分解
A.①②③⑤ B.①②④⑤ C.①②⑥ D.①②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列有关电化学的内容正确的是
A.马口铁和白铁皮破损后,白铁皮比马口铁腐蚀快,所以使用白铁皮时要注意防止铁皮出现刮痕
B.原电池中电子从负极流出流入正极,电解池中电子从阴极流出流入电源负极
C.已知磷酸亚铁锂电池总反应为FePO4 + Li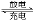 LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阳极电极反应式为:LiFePO4+e-=FePO4+Li+
LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阳极电极反应式为:LiFePO4+e-=FePO4+Li+
D.常温下以C选项中电池为电源以石墨为电极电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14(忽略溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:填空题
(10分)按要求填空:
(1)2.7 g H2O所含氢原子数与 L(标准状况下)NH3所含氢原子数相等。
(2)以下物质:① NH3 ② CaCO3 ③ 蔗糖 ④ 饱和食盐水 ⑤ H2SO4 ⑥ Cu
属于电解质的有 (填序号)。
(3)用单线桥标出下列反应中电子转移的方向和数目:
MnO2+4HCl(浓) 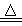 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
① 该反应中的氧化剂是 。
②如反应中转移了0.2 mol电子,则产生的Cl2在标准状况下体积为 L。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com