
 元素周期表中有五种元素的性质或原子结构信息如下:
元素周期表中有五种元素的性质或原子结构信息如下:分析 X元素的气态氢化物的水溶液呈弱碱性,则X为N元素; Y元素是第三周期元素的简单离子中离子半径最小,则Y为Al;Z是用量最大、用途最广的金属单质,则Z为Fe;Q位于第二周期且族序数是周期数的2倍,则Q为C元素;R元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则R为O元素.
(4)A、B、C为均含有Al元素或均含有Fe元素的三种无机物,①若D为氯碱工业的重要产品,则A为铝盐、D为NaOH、B为Al(OH)3,C为NaAlO2;
②若D为稀硝酸,则A为Fe,B为硝酸亚铁,C为硝酸铁.
解答 解:X元素的气态氢化物的水溶液呈弱碱性,则X为N元素; Y元素是第三周期元素的简单离子中离子半径最小,则Y为Al;Z是用量最大、用途最广的金属单质,则Z为Fe;Q位于第二周期且族序数是周期数的2倍,则Q为C元素;R元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则R为O元素.
(1)Z为Fe元素,在周期表中的位置为:第四周期第Ⅷ族,Q为碳元素,含有8个中子的原子组成符号是146C,
故答案为:第四周期第Ⅷ族;146C;
(2)上述五种元素中有两种元素分别和R形成化合物M、N,它们:摩尔质量、分子中所含原子数、分子中的核外电子数都相同,也属于等电子体,应为CO2或N2O,故答案为:CO2或N2O;
(3)X与元素周期表中第一号元素形成的10电子阳离子为NH4+,的空间构型为正四面体,X的最高价氧化物对应的水化物为硝酸,其浓溶液与同类物质相比在化学性质上表现的特殊性有:不稳定性和强氧化性,
故答案为:正四面体;不稳定性和强氧化性;
(4)A、B、C为均含有Al元素或均含有Fe元素的三种无机物,①若D为氯碱工业的重要产品,则A为铝盐、D为NaOH、B为Al(OH)3,C为NaAlO2,反应(Ⅲ)的离子方程式:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
②若D为稀硝酸,则A为Fe,B为硝酸亚铁,C为硝酸铁,检验B溶液中亚铁离子时:先加KSCN溶液,溶液不变红色,再加双氧水,溶液变为红色,说明含有亚铁离子,故答案为:b.
点评 本题考查元素化合物的推断,推断元素是解题关键,注意对基础知识的理解掌握.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
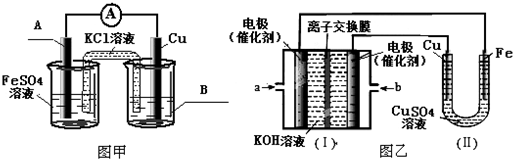
| A. | 甲有可能是AlO2- 也有可能是Al3+ | |
| B. | 若乙为无色无味气体,则甲一定是CO32- | |
| C. | 若甲是具有刺激性气味的气体,则甲、乙具有相同的电子数 | |
| D. | 若甲、乙均为离子,甲、乙两种离子在同一溶液中一定不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
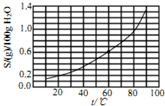
| A. | 25℃时,溴酸银微溶于水 | |
| B. | 溴酸银溶解度随温度升高而增大 | |
| C. | 60℃时溴酸银的Kap约等于2.5×10-4 | |
| D. | 往溴酸银浊液中滴加NaI有黄色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
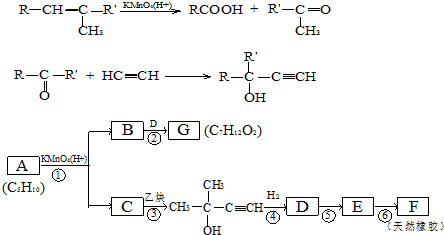
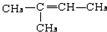 ,CCH3COCH3,ECH2=C(CH3)CH=CH2
,CCH3COCH3,ECH2=C(CH3)CH=CH2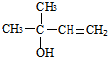 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$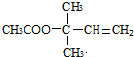 +H2O;
+H2O; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,水溶液一定从下口放出 | |
| B. | 蒸馏时,如果温度计水银球下端高于蒸馏烧瓶支管口上沿,收集到的馏分沸点偏高 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 | |
| D. | 量取20.0mL浓硫酸时,俯视读数,所取液体体积偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeC12+C12=2FeC13 | B. | Fe+CuSO4=Cu+FeSO4 | ||
| C. | C12+2NaOH=NaC1+NaC1O+H2O | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 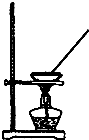 如图所示装置获得碳酸氢钠固体 | B. | 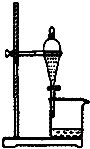 如图所示装置分离乙酸和乙酸乙酯 | ||
| C. | 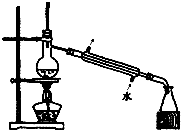 如图所示装置制取少量蒸馏水 | D. | 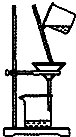 如图所示装置提纯氢氧化铁胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com