
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
分析 分子式为C8H8O2的有机物能与NaHCO3发生反应产生CO2,说明含有羧基-COOH,芳香族化合物一定含有苯环,该有机物的不饱和度为$\frac{9×2+2-8}{2}$=6,因此含有一个碳碳双键,据此判断该有机物可能含有的官能团及结构.
解答 解:芳香化合物中一定含有苯环,该有机物能与饱和NaHCO3溶液反应放出气体,则其分子中含有羧基,1个苯环和羧基的不饱和度为:4+1=5,该有机物的不饱和度为$\frac{9×2+2-8}{2}$=6,因此含有一个碳碳双键,
苯环中含有6个碳原子,羧基中含有1个C原子,则该苯环侧链可能组成有:
①1个-CH=CHCOOH、-CH(COOH)=CH2,形成有机物为C6H5-CH=CHCOOH、C6H5-CH(COOH)=CH2;
②1个-CH=CH2和1个-COOH,存在邻、间、对三种结构,
所以满足条件的有机物总共有5种,
故选B.
点评 本题考查了有机物结构与性质的应用,题目难度不大,明确常见有机物官能团及具有性质为解答关键,注意掌握同分异构体的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
 +12MnO${\;}_{4}^{-}$+36H+→
+12MnO${\;}_{4}^{-}$+36H+→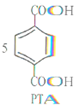 +12Mn2++28H2O.
+12Mn2++28H2O.| A. | PTA是该反应的氧化产物 | B. | 消耗1molPX,共转移8mol电子 | ||
| C. | PX含苯环的同分异构体还有3种 | D. | PTA与乙二醇可以发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的工作环境应在高温条件下 | |
| B. | 正极反应:O2+2H2O+4e-═4OH- | |
| C. | 电池工作时葡萄糖在负极上失去电子发生还原反应 | |
| D. | 电池工作时H+由负极移向正极,电解质溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Q | X | ||
| Y | Z | W | |
| T |
| A. | X、Z、Y元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、W元素在自然界中均能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | Q与氢元素形成的化合物中不存在非极性共价键 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,最高价氧化物对应水化物的化学式是H3TO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. | 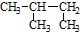 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1000 |
| C(H2O)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| C(CO2)/mol•L-1 | 2.50 |
| A. | 在500s内用H2O(g)表示的化学反应速率是2.96×10-3mol•L-1•s-1 | |
| B. | 在500s时生成的CH4的浓度是0.74mol•L-1 | |
| C. | 在1000s时反应达到平衡 | |
| D. | 0-500s的平均反应速率大于500~1000s的平均反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
物理量 实验序号 | 0.1mol?L-1Fe2(SO4)3 的体积/mL | 30% H2O2 的体积/mL | H2O 的体积/mL |
| 1 | 0.5 | 15 | 24.5mL |
| 2 | 0.5 | 30 | 9.5 |
 N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.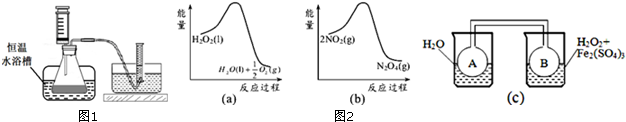
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com