
【题目】以甲烷为原料合成甲醇的反应如下:
反应I:CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g) △H1= +247 kJ/mol
2CO(g) + 2H2(g) △H1= +247 kJ/mol
反应II:CO(g) + 2H2(g)![]() CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
已知: T1℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是
A. 反应I中,使用催化剂可以减小△H1,提高反应速率
B. 反应II 中,加热或加压均可提高原料气的平衡转化率
C. 由上述数据可判断反应II 的温度: T1> T2
D. CO(g)+CH3OH(g)![]() CH4(g) +CO2(g) △H= +157 kJ/mol
CH4(g) +CO2(g) △H= +157 kJ/mol
【答案】C
【解析】A、反应热只与始态和终态有关,使用催化剂降低活化能,化学反应速率加快,但△H1不变,故A错误;B、正反应是放热反应,加热,平衡向逆反应方向移动,原料气的转化率降低,反应前气体系数之和大于反应后气体系数之和,增大压强,平衡向正反应方向移动,原料气的转化率增大,故B错误;C、T2℃时的化学平衡常数K=![]() =2<100,反应II的正反应为放热反应,温度升高,化学平衡常数减小,即T1℃>T2℃,故C正确;D、反应I+反应II得到CH4(g)+CO2(g)
=2<100,反应II的正反应为放热反应,温度升高,化学平衡常数减小,即T1℃>T2℃,故C正确;D、反应I+反应II得到CH4(g)+CO2(g)![]() CO(g)+CH3OH(g) △H=(274-90)kJ·mol-1=+184kJ·mol-1, CO(g)+CH3OH(g) CH4(g) +CO2(g) △H=-184kJ·mol-1,故D错误。
CO(g)+CH3OH(g) △H=(274-90)kJ·mol-1=+184kJ·mol-1, CO(g)+CH3OH(g) CH4(g) +CO2(g) △H=-184kJ·mol-1,故D错误。


科目:高中化学 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯. 已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g);△H1=+156.6kJmol﹣1
CH3CH=CH2(g)=CH4(g)+HC≡CH(g);△H2=+32.4kJmol﹣1
则相同条件下,反应C3H8(g)=CH3CH=CH2(g)+H2(g)的△H=kJmol﹣1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式;放电时,CO32﹣移向电池的 (填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10﹣5 mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3﹣+H+的平衡常数K1= . (已知:10﹣5.60=2.5×10﹣6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水玻璃是建筑行业常用的粘合剂,并可用于木材防火和防腐处理。水玻璃为
A. CaSiO3固体 B. SiO2
C. Na2SiO3水溶液 D. H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亚铁在水中的溶解度如下图:
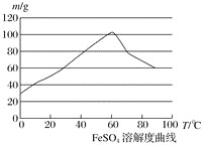
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯是化工生产中常用的方法。下列说法合理的是
A. 蒸馏自来水可得到蒸馏水
B. 酸溶法除去Al2O3的Fe2O3
C. 过滤法除去乙酸中的乙醇
D. 碱溶法除去Al2O3中的SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X 的最高价含氧酸的化学式为 HnXO2n﹣2,则在其气态氢化物中 X 的化合价为( )
A.﹣(12﹣5n)B.﹣(12﹣3n)C.﹣(6﹣3n)D.﹣(10﹣n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有较多Ca2+、Mg2+和HC![]() O3-的水称为暂时硬水,加热可除去Ca2+、Mg2+ , 使水变为软水.现有一锅炉厂使用这种水,试判断其水垢的主要成分为( ) (已知Ksp(MgCO3)=6.8×10﹣6 , Ksp[Mg(OH)2]=5.6×10﹣12)
O3-的水称为暂时硬水,加热可除去Ca2+、Mg2+ , 使水变为软水.现有一锅炉厂使用这种水,试判断其水垢的主要成分为( ) (已知Ksp(MgCO3)=6.8×10﹣6 , Ksp[Mg(OH)2]=5.6×10﹣12)
A.CaO、MgO
B.CaCO3、MgCO3
C.CaCO3、Mg(OH)2
D.CaCO3、MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:Fe2+>Br-。向100mLFeBr2溶液中通入3.36L(标准状况)Cl2,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原溶液中FeBr2的物质的量浓度为( )
A. 2 mol·L-1 B. 1.5 mol·L-1 C. 1 mol·L-1 D. 0.75 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com