
| A.M原子的最外层电子数比N原子的最外层电子数少 |
| B.常温时,M单质能从水中置换出氢气,而N单质不能反应 |
| C.1molM从稀H2SO4中置换出的H2比lmolN从稀H2SO4中置换出的H2多 |
| D.在最高价氧化物的水化物中,M的化合价比N高 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:问答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | ② | ||||||
| 二 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 三 | ⑧ | ⑨ | ⑩ | (11) | ||||
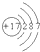 所表示的原子是______.(写元素符号)
所表示的原子是______.(写元素符号)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所含四种元素的原子半径由小到大的顺序为:H<O<N<C | ||
| B.同周期的三种元素的得电子能力由大到小的顺序为:O>N>C | ||
| C.除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 | ||
D.其与足量氢氧化钠溶液共热的离子方程式为:NH4++OH-
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素非金属性:F>O>N |
| B.热稳定性:PH3>H2S>HCl |
| C.酸性:HClO4>H3PO4>H2SO4 |
| D.原子半径:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y、Z的气态氢化物,前者更稳定 |
| B.Z、W的最高价氧化物对应水化物的酸性,前者强 |
| C.X、W的气态氢化物相互反应,生成物中既含离子键又含共价键 |
| D.Y、W的单质,均可通过电解的方法获得 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属性:Y>Z>M |
| B.M2是由非极性共价键构成的分子 |
| C.原子半径:M>Z>Y |
D.Y离子的结构示意图可表示为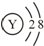 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na是第三周期中金属性最强的元素 |
| B.Cl是第三周期中非金属性最强的元素 |
| C.A1的氧化物属于两性氧化物 |
| D.Si的最高氧化物的水化物属于强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com