
【题目】草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,110 ℃可完全失去结晶水,是制备某些铁触媒的主要原料。实验室通过下列方法制备Ka[Fe(C2O4)b]·cH2O并测定其组成:
Ⅰ.草酸合铁酸钾晶体的制备
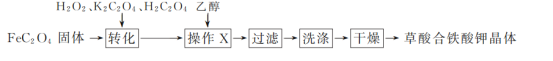
(1)“转化”过程中若条件控制不当,会发生H2O2氧化H2C2O4的副反应,写出该副反应的化学方程式:_________________________。
(2)“操作X”中加入乙醇的目的是_______________________。
Ⅱ. 草酸合铁酸钾组成的测定
步骤1:准确称取两份质量均为0.4910 g的草酸合铁酸钾样品。
步骤2:一份在N2氛围下保持110℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱,发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
(3)若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量________(填“偏大”“偏小”或“不变”)。
(4)通过计算确定草酸合铁酸钾样品的化学式(写出计算过程)。 ________
【答案】H2O2+H2C2O4=2CO2↑+2H2O 降低草酸合铁酸钾的溶解度,促进草酸合铁酸钾的析出 偏小 K3[Fe(C2O4)3]·3H2O
【解析】
(1)H2O2具有氧化性,草酸具有还原性,二者会发生氧化还原反应,结合电子守恒、原子守恒书写;
(2)根据草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,结合实验目的分析;
(3)若不洗涤,在固体表明会残留K+,据此判断K+的多少;
(4)先根据盐失重质量计算结晶水的物质的量,根据Cl-+Ag+=AgCl↓,由消耗AgNO3的物质的量计算Cl-的物质的量,再交换树脂的交换柱反应中微粒关系由Cl-得到K+及[Fe(C2O4)b]a-的物质的量,再根据化合物中化合价代数和等于0及固体在受热分解前后质量关系,找出a、b的关系,求出微粒物质的量的比,最后得到物质化学式。
(1)H2O2具有氧化性,草酸具有还原性,二者会发生氧化还原反应,根据反应过程在电子守恒、原子守恒,可得反应方程式为:H2O2+H2C2O4=2CO2↑+2H2O;
(2)由于草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,为降低草酸合铁酸钾的溶解度,促进草酸合铁酸钾的析出,因此要使用乙醇;
(3)若步骤3中未用蒸馏水冲洗交换柱,则一部分K+残留在交换柱内,使测得的样品中K+的物质的量偏少;
(4)0.4910 g的草酸合铁酸钾n(H2O)=(0.4910-0.4370)g÷18 g/mol=3×10-3 mol;
n(Cl-)=n(Ag+)=0.1500 mol/L×20.00×10-3 L=3×10-3 mol,根据离子交换柱中发生的反应:
a RCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,可得样品中n(K+)=n(Cl-)=3×10-3 mol,n{[Fe(C2O4)b]a-}=![]() mol;110 ℃残留固体是晶体失去结晶水后的产物即K+和[Fe(C2O4)b]a-的总质量,则3×10-3 mol×39 g/mol+
mol;110 ℃残留固体是晶体失去结晶水后的产物即K+和[Fe(C2O4)b]a-的总质量,则3×10-3 mol×39 g/mol+![]() mol×(56+88b)g/mol=0.437 0 g
mol×(56+88b)g/mol=0.437 0 g
Ka[Fe(C2O4)b]中根据电荷守恒关系可得:a+3=2b,解得a=3,b=3,n{[Fe(C2O4)3]3-}=1×10-3 mol,
n(K+):n{[Fe(C2O4)3]3-}:n(H2O)=(3×10-3 mol):(1×10-3 mol):(3×10-3 mol)= 3∶1∶3,
所以该盐化学式为K3[Fe(C2O4)3]·3H2O。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】实验室用含铜的铁粉制备 FeCl3的流程如下:
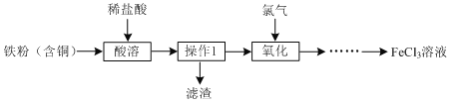
(1)为加快酸溶速率,可采取的措施有______(回答一点即可)。
(2)酸溶后检验所得溶液是否含有Fe3+的方法为______。
(3)操作1的名称______。
(4)氧化过程中发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔与甲苯为主要原料,按下列路线合成一种香料W:
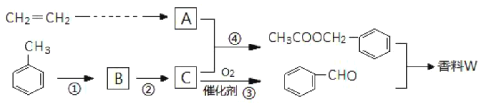
(1)写出实验室制备乙炔的化学方程式___________。
(2)反应①的反应试剂、条件是________,上述①~④反应中,属于取代反应的是________。
(3)写出反应③的化学方程式_____________。
(4)检验反应③是否发生的方法是_______。
(5)写出两种满足下列条件的![]() 同分异构体的结构简式______。
同分异构体的结构简式______。
a.能发生银镜反应 b.苯环上的一溴代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
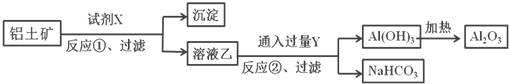
A. 反应①中试剂X是氢氧化钠溶液
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应中包含一个氧化还原反应
D. 将试剂X和Y进行对换,最终可以达到相同的效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苋菜甲素、3-丁烯基苯酞、藁本内酯是传统中药当归、川芎中的活性成分。下列有关说法正确的是( )
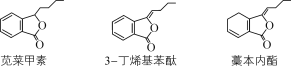
A.苋菜甲素、藁本内酯互为同分异构体
B.1 mol 3-丁烯基苯酞与溴水反应最多消耗4 mol Br2
C.3-丁烯基苯酞通过还原反应可制得苋菜甲素
D.藁本内酯与足量H2加成的产物分子中含有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提供几组常见的实验装置示意图,下列有关叙述正确的是
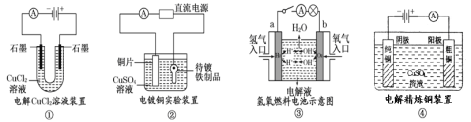
A.装置①中阳极上有无色无味气体冒出
B.装置②中的铜片应与直流电源的负极相连
C.装置③中,若电解液为KOH溶液,则电极a的反应式:H2-2e-+2OH-=2H2O
D.装置④阳极减少的质量一定等于阴极增加的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、FeO、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图:
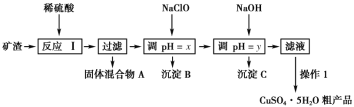
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是__(任写1条)。
(2)固体混合物A中的成分是__。
(3)反应Ⅰ完成后,铁元素的存在形式为__(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式__。
(4)操作1主要包括:__、__、__。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是__。
(5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为__,该反应中氧化剂与还原剂的物质的量之比为__。
(6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)以其优良的还原性能在医药、香料、农药、染料等行业中广泛应用。纯氢化铝锂是一种白色晶状固体,熔点 125℃,加热至 130℃时分解,溶于醚、四氢呋喃,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应。目前世界上有四种工业生产 LiAlH4的方法,其中施莱兴格(Schlesinger)法和高压合成法最为常见。
Ⅰ. 施莱兴格(Schlesinger)法
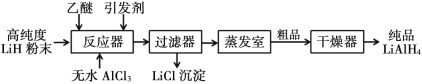
Ⅱ.高压合成法
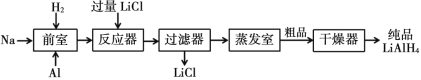
请根据题中信息回答以下问题:
(1)Schlesinger 中的反应器需要附加电磁搅拌器,目的是________。
(2)Schlesinger 的反应器中发生的化学反应方程式是________。
(3)采用 Schlesinger 时需要使用大量高纯度氩气,氩气的作用是________。
(4)为了降低成本,在 Schlesinger 工艺中有一种原料可以循环使用,这种原料是________。
(5)已知乙醚沸点为 35℃,某工厂准备在蒸发室采用减压蒸发分离出产品,你认为有无必要,请简述理由________。
(6)两种工艺均使用过滤器,中学实验室中过滤装置需要的玻璃仪器有________。
(7)使用氢化铝锂要注意安全, 少量未反应完的需要分解处理。其中一种处理方法是向其中缓慢加入适量的稀盐酸,待无气体放出后视为处理完全。请写出此过程的化学反应方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是
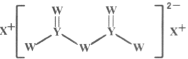
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.化合物M中W不都满足8电子稳定结构
D.W的简单氢化物稳定性比Y的简单氢化物稳定性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com