
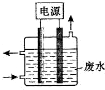
分析 (1)废水中含CN-,控制溶液pH为9~10并加入NaCl,阳极产生的ClO-将CN-氧化,说明溶液中的氯离子在阳极失去电子发生氧化反应,阴极是氢离子得电子产生氢气,铁是活性电极,在装置中只能作阴极,不参加反应;
(2)根据离子反应方程式CN-+H2O2+H2O═A+NH3↑可知,N化合价为-3价,反应前后不改变,只能是双氧水将C从+2介氧化到+4价,根据电荷守恒和原子守恒解答;
(3)Fe(OH)3是弱碱,HCN是弱酸,则K3[Fe(CN)6]在中性溶液中有Fe3+和CN-发生微弱水解;
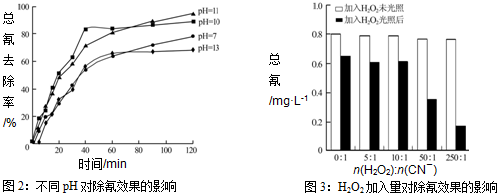
(4)图2显示,PH在10-11时,除氰率超过80%,碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒);
(5)根据v=$\frac{△c}{△t}$计算.
解答 解:(1)废水中含CN-,控制溶液pH为9~10并加入NaCl,阳极产生的ClO-将CN-氧化,说明溶液中的氯离子在阳极失去电子发生氧化反应,电极反应为:2OH-+Cl--2e-═ClO-+H2O,阴极是氢离子得电子产生氢气,铁是活性电极,在装置中只能作阴极,不参加反应,
故答案为:阴极;2OH-+Cl--2e-═ClO-+H2O;
(2)根据离子反应方程式CN-+H2O2+H2O═A+NH3↑可知,N化合价为-3价,反应前后不改变,只能是双氧水将C从+2介氧化到+4价,根据电荷守恒和原子守恒,A应是带一个负电荷的阴离子,且包含1个C,1个H,3个O,即HCO3-,
故答案为:HCO3-;
(3)Fe(OH)3是弱碱,HCN是弱酸,则K3[Fe(CN)6]在中性溶液中有Fe3+和CN-发生微弱水解,即[Fe(CN)6]3-+3H2O?Fe(OH)3+3HCN+3CN-,
故答案为:[Fe(CN)6]3-+3H2O?Fe(OH)3+3HCN+3CN-;
(4)图2显示,PH在10-11时,除氰率超过80%,碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒),
故答案为:b;碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒);
(5)剩余总氰为0.16mg•L-1,除氰率达80%,则氰的总量为:0.16mg•L-1÷(1-80%)=0.80mg•L-1,
0-30分钟氰的改变量为:△c(CN-)=0.80mg•L-1×80%=0.64mg•L-1,v(CN-)=$\frac{△c(C{N}^{-})}{△t}$=$\frac{0.64mg/L}{30min}$=0.021mg•L-1min-1,
故答案为:0.021.
点评 本题考查电解原理以及盐类水解的应用,利用氧化还原反应化合价的改变,守恒思想的应用是解题的关键,图象多增大了信息量,注意有效信息的获取,题目难度中等.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子交换树脂 | B. | 阴离子交换树脂 | ||
| C. | 阳离子交换树脂和阴离子交换树脂 | D. | 离子交换树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ─C≡C─ | ─CH3 | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH | -COO-R |

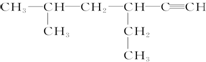
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火力发电厂的煤经粉碎、脱硫处理 | B. | 电镀废液经中和后直接排入到农田 | ||
| C. | 聚乳酸塑料代替传统塑料作购物袋 | D. | 回收并合理处理聚氯乙烯塑料废物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com