
科目:高中化学 来源: 题型:
研究表明,化学反应中的能量变化其本质是化学键的生成或断裂过程中分别会释放与吸收能量.如图表示反应2H2(g)+O2(g)═2H2O(g)的能量变化,下列有关说法中错误的是( )

|
| A. | 图中的①是指吸收能量,②是指放出能量 |
|
| B. | 图示说明反应2H2(g)+O2(g)═2H2O(g)是一个吸热反应 |
|
| C. | 图示说明化学键的形成与断裂是物质在化学反应中发生能量变化的主要原因 |
|
| D. | ③中a所指的数值为484 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 锌与稀硫酸反应:Zn+2H+=Zn2++H2↑ |
|
| B. | 碳酸钙与稀硝酸反应:CO32﹣+2H+=H2O+CO2↑ |
|
| C. | 氢氧化铝与盐酸反应:H++OH﹣=H2O |
|
| D. | 氯化镁溶液与氢氧化钠溶液反应:Mg2++OH﹣=Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)具有明显现象的官能团特征反应常被用来鉴定化合物. ①欲区分CH3CH2OH和CH3CHO,应选用 B (填字母).
A.NaOH溶液 B.银氨溶液 C.盐酸
②欲区分 和
和 应选用 A (填字母).
应选用 A (填字母).
A.KMnO4溶液 B.溴水 C.Na2CO3溶液
③欲区分 和
和 应选用 C (填字母).
应选用 C (填字母).
A.AgNO3溶液 B.NaOH溶液 C.FeCl3溶液
(2)在有机化学中,同分异构是普遍存在现象. 分子式为C4H9Br的有机物共有 4 种不同结构.其中,一种有机物通过消去反应可转变为2﹣丁烯,请写出该消去反应的化学方程式 CH3CH2CHBrCH3 CH3CH=CHCH3+H2O ;另一种有机物的核磁共振氢谱图中显示只有一个峰,请写出该有机物的结构简式:
CH3CH=CHCH3+H2O ;另一种有机物的核磁共振氢谱图中显示只有一个峰,请写出该有机物的结构简式:  .
.
(3)聚丁二酸乙二醇酯(PES)是一种生物可降解的聚酯,它在塑料薄膜,食品包装和生物材料方面有着广泛的应用.其结构简式如下:

①聚丁二酸乙二醇酯(PES)是由两种单体通过 缩聚 反应(填反应类型)制得的.形成该聚合物的两种单体是 HOOCCH2CH2COOH 和 HOCH2CH2OH .
②这两种单体相互之间也可能形成一种八元环状酯,请写出该环状化合物的结构简式:  .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的叙述不正确的是 ( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过
程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是 ( )
A.0.02 mol/(L•min) B. 1.8mol/(L•min) C.1.2 mol/(L•min) D.0.18 mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。请回答:
(1)与(HB=NH)3互为等电子体的分子为 (填分子式)。
(2)下列关于合成A的化学方程式的叙述不正确的是 (填选项字母)。
a.反应前后碳原子的轨道杂化类型不变
b.CH4、H2O、CO2的分子空间构型分别为正四面体形、V形、直线形
c.第一电离能的大小关系为:N>O>C>B
d.A中存在配位键
(3)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中共有
个硼原子, 个氮原子。
(4)人工可以合成硼的一系列氮化物,其物理性质与烷烃相似,故称之为硼烷。工业上采用LiAlH4和BF3,在乙醚介质中反应制得乙硼烷(B2H6) ,同时生成另外两种产物,该反应的化学方程式为 。
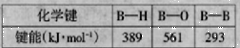 (5)相关化学键的键能如下表所示,简要分析和解释下列事实。
(5)相关化学键的键能如下表所示,简要分析和解释下列事实。
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化物,其原因为
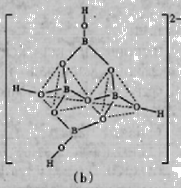 (6)在硼酸盐中,阴离子有链状、环状、骨架状等多种结
(6)在硼酸盐中,阴离子有链状、环状、骨架状等多种结
构形式,图(a)为一种无限长单链状结构的多硼酸根,
其化学式为 ;图(b)为硼砂晶体中的阴
离子,其中硼原子采取的杂化类型 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com